Phosphordiesterbindung - Verständnisfrage Phosphat/Phosphorsäure/Ester?
Hallo zusammen
Den Mechanismus der Veresterung habe ich prinzipiell verstanden, Säure + Alkohol <-> Ester + Wasser ... ich habe aber bei der Phosphodiesterbindung Verständnisprobleme.
- In den Lehrbüchern und vielen Texten ist immer wieder die Rede von Phosphat - aber das ist doch ein Salz und keine Säure, wie kann denn damit ein Ester entstehen?

- Manchmal steht dann doch wieder "Phosphorsäure", wie am Beispiel hier. Die Ladungen sind bei verschiedenen Darstellungen aber auch wieder verschieden. In der oberen Darstellung ist ein O-Atom negativ geladen, in der unteren nicht.
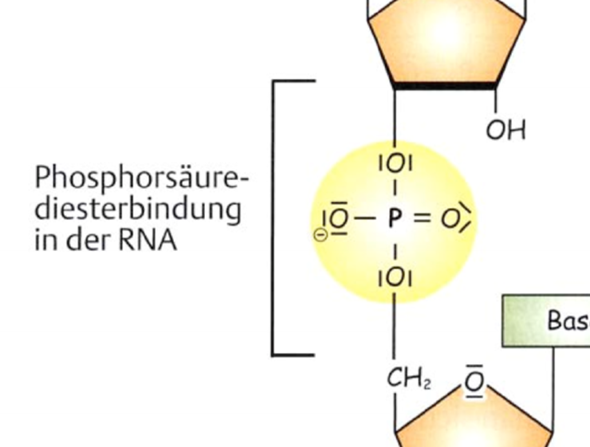

Ich bin relativ verwirrt. Könntet ihr mir die Unterschiede erklären?
Vielen Dank! :)
1 Antwort

Moin,
ja, das kommt davon, wenn (zum Beispiel in der Biologie) die (chemische) Fachsprache nicht korrekt verwendet wird.
Deine Verwirrung ist nur allzu verständlich. Chemisch korrekt sind folgende Begriffe:
Phosphorsäure: H3PO4
Dihydrogenphosphat-Anion: H2PO4^–
Hydrogenphosphat-Anion: HPO4^–
Phosphat-Anion: PO4^3–
Von der Phosphorsäure kommst du schrittweise über das Dihydrogenphosphat-Anion und das Hydrogenphosphat-Anion zum Phosphat-Anion, wenn du hintereinander ein Proton nach dem anderen abspaltest.
Die Phosphorsäure ist eine Säure (Name!) und somit per Definition ein Protonendonator. Das Dihydrogenphosphat-Anion ist zum Beispiel Bestandteil von Salzen. Aber da es auch noch über zwei abspaltbare Wasserstoffatome verfügt, kann es (in Lösung) auch wie eine Säure reagieren. Dasselbe trifft (in schwächerer Form) auch auf das Hydrogenphosphat-Anion zu.
Aber (vor allem) in der Biologie nimmt man das hier nicht so genau. Weil das Phosphat-Anion aus der völlig deprotonierten Phosphorsäure resultiert, wird zum Beispiel bei der Beschreibung der DNA sprachlich oft nicht unterschieden, welche Phosphat-Struktur nun tatsächlich verbaut ist.
Du hast natürlich recht: Das in der oberen Darstellung zu sehende deprotonierte Phosphat in der Diesterbindung kann ohne (s)ein letztes Proton keine (weitere) Esterbindung ausbilden, weil so, wie es da zu sehen ist, ein Proton für die Abspaltung des Wassermoleküls fehlt. Andererseits geht man davon aus, dass das Proton, das hier nicht mehr zu sehen ist (negative Ladung am Sauerstoff), irgendwo sein muss (zum Beispiel an ein Wassermolekül gebunden, das dadurch zum Oxoniumion, H3O^+, wird). Und dann kann man sich natürlich leicht vorstellen, dass mit Hilfe dieses Protons eine weitere Veresterung möglich ist. Wie gesagt, eine saubere Darstellung des (gesamten) Sachverhalts mit allen korrekten Fachbegriffen ist das nicht.
Du kannst es so sehen: In der Biologie (oder molekularen Biochemie) ist es nicht so wichtig, ob du bei der DNA (oder Nukleotiden...) von Phosphorsäure, Dihydrogenphosphat, Hydrogenphosphat oder Phosphat sprichst.
Davon gibt es noch andere Beispiele: In der Biologie bezeichnet man die Verknüpfung von zwei Aminosäuren als Peptidbindung. Chemiker bezeichnen diesen Bindungstyp dagegen als (Säure-)Amidbindung.
Ich hoffe, dass du es hinnehmen kannst. Chemisch ist das eine schlechte, weil ungenaue Fachsprache, aber für die Vorgänge selbst ist das eher unerheblich, weil in dem ganzen Milieu, in dem sich das alles abspielt, immer genügen Protonen vorhanden sind...
LG von der Waterkant

WOW, danke! Hat mir sehr viel Klarheit geliefert. Dich bräuchte man als Dozent :)