Unterschied zwischen Dipol-Dipol Kräften und einer polaren Atombindung?
1 Antwort

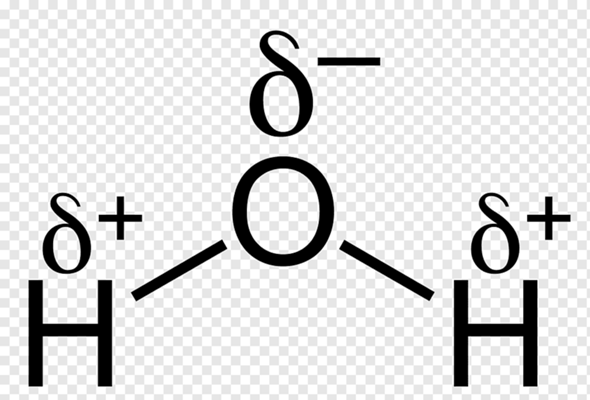
Eine Polare Bindung ist eine kovalente Bindung mit relativ hohem Eletronegativitätsunterschied. Sie ist also eine Bindung mehrerer Atome zu einem Kollektiv (dem Molekül). Dabei werden bestimmte Valenzelektronen durch die Differenz in der Elektronegativitiät zwar eher in eine Richtung gezogen, als in die andere, führen aber dennoch dazu, dass Atome "zusammen bleiben". Dieses Stärker in eine Richtung gezogen werden hat eine sogenannte Partialladung zur Folge. Diese ist negativ, wo eine grössere Elektronegativität herrscht und positiv, wo eine geringere herrscht, da die Aufenthalswahrscheinlichkeit eines Elektrons in diesem Gebiet geringer ist.
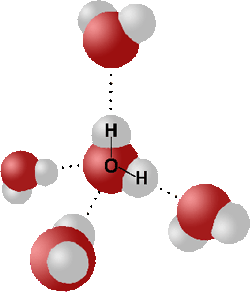
Dipol-Dipol Kräfte hingegen, sind Zwischenmolekulare Kräfte, also Kräfte, die zwischen Molekülen wirken. Sie entsehen durch polare Bindungen, also Elektronegativitätsdifferenzen und den daraus resultierenden Partialladungen.
Dipol-Dipol Kräfte sind wohl am einfachsten mit einem Wassermolekül (oder besser mit mehreren zu erklären.
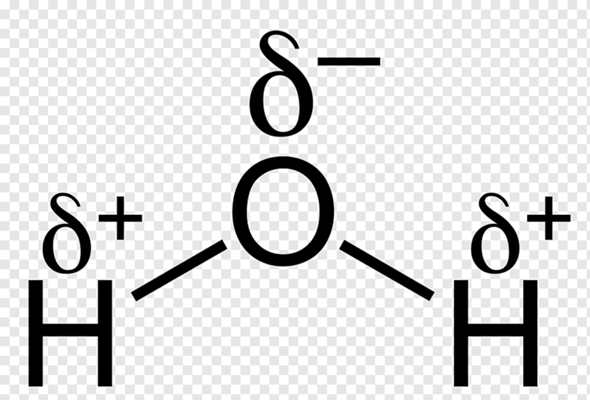
Das steht hierbei für eine positive Partialladung, während das
für eine Negative Partialladung steht.
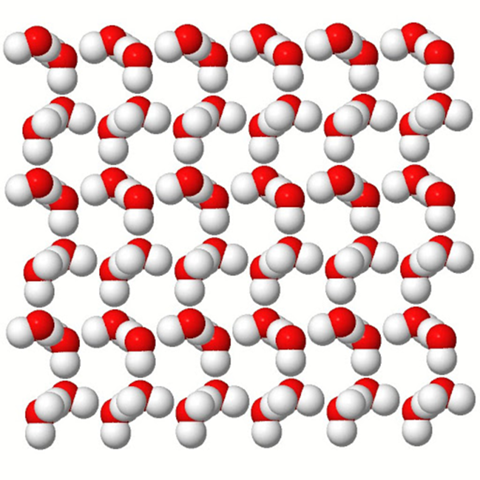
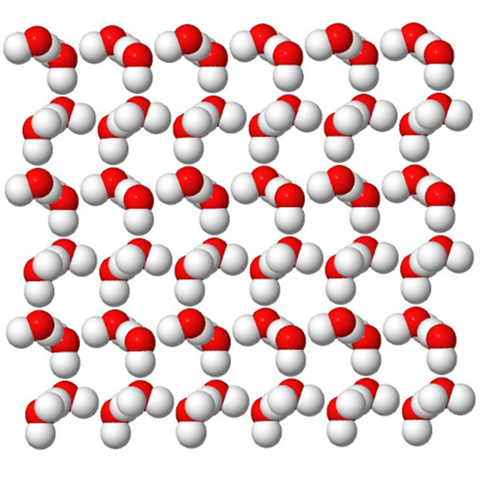
Wasser gilt als Dipol, weil es (tadaa) 2(=Di) Pole hat. Wenn du dir nun viele Wassermoleküle vorstellst, dann richten sie sich so aus, dass sich jeweils die positiven Partialladungen des eines Moleküls, mit den negativen Partialladungen des anderen Moleküls und umgekehrt nähern.
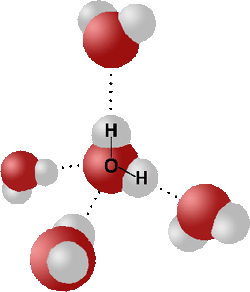
Daher bildet Wasser auch sozusagen kleine Gitter und winzige Kristalle