Pufferkapazität berechnen
Hallo, ich soll die Pufferkapazität eines Essigsäure-Acetat-Puffers berechnen.
Der Puffer hat ein Volumen von 100ml ; Die Konzentration beträgt 0,1 mol pro L ; Das Verhältnis von Essigsäure und Acetat ist 1:1
Kann mir bitte jemand erklären, wie man jetzt die Pufferkapazität berechnet? Hab schon überall nachgeschaut, aber hab dazu nichts gefunden.
3 Antworten

Ich weiß nun nicht, ob ihr im Chemieunterricht bei der Berechnung der Pufferkapazität das Gleiche meint wie ich. Ich gebe Dir deshalb zunächst allgmeine Informationen zu diesem Pufferproblem und gehe dann auf den von Dir angegebenen Puffer ein.
Die Pufferkapazität β gibt die Änderung des pH-Wertes einer Pufferlösung in Abhängigkeit vom Zusatz einer Säure bzw. einer Base an und hat die Einheit 1 mol/L. Es ist
β=Δc/ΔpH
So hat ein Puffersystem z.B. die Kapazität β = 1, wenn sich bei Zugabe von n(H₃O⁺) = 1 mol bzw. n(OH⁻) = 1 mol zu 1 L Pufferlösung der pH-Wert um eine Einheit ändert.
Die Pufferkapazität hängt von der Gesamtkonzentration des Puffersystems ab: Je konzentrierter eine Pufferlösung ist, desto größer ist ihre Pufferkapazität. Die Pufferkapazität wird auch von der Zusammensetzung des Systems bestimmt - sie erreicht ein Maximum, wenn äquimolare Mengen an schwacher Säure und konjugierter Base enthalten sind.
Es gilt die folgende Regel: Ein Puffer ist dann erschöpft, sobald das Verhältnis der Säure/Base Konzentration den Wert 1 : 10 (bzw. 10 : 1) überschreitet. Der pH-Wert eines Puffers kann daher um +/− 1 schwanken, bevor er erschöpft ist.
Nun zu Deinem Problem:
Es ist die Gleichung von Henderson-Hasselbalch („Pufferungsgleichung“) auf den gegebenen Puffer angewandt:
pH = pKs(Essigsäure) + lg [c(Acetationen): c(Essigsäure)]
Beachte bei Deinen Berechnungen, dass V(Pufferlösung) = 100 mL = 0,1 L ist. Da äquimolare Konzentrationen des gegebenen Puffers vorliegen, hat dieser hier seine maximale Kapazität.Gibt man z.B. Salzsäure der Konzentration c = a mol/L zu der gegebenen Pufferlösung, dann reagieren die Oxoniumionen aus der Salzsäure vollkommen mit den Acetationen des Puffers zu Essigsäuremolekülen. Die Konzentration der Acetationen verändert sich dann um 0,1 mol/L – a mol/L und die der Essigsäure um 0,1 mol/L + a mol/L.
Nun solltest Du mit dem, was ich hier geschrieben habe, eine Pufferkapazität berechnen können.

Weißt du, wie du ausrechnen kannst, wie sich der pH-Wert verschiebt, wenn du eine bestimmte Menge einer starken Säure/Base hinzugibst?
Nimm die maximal zulässige Abweichung vom Ausgangswert und stelle die Gleichung um in die zugesetzte Stoffmenge.

Die naheliegende Variante ist, daß Du es mit einer finiten Differenz machst.
Du hast einen symmetrischen Puffer, der pH ist also gleich dem pK. Mir ist nicht klar, ob Du meinst, daß der Puffer je 1 mol/l Essigsäure und Acetat enthält, oder oder zusammen ein Mol von beidem, also je 0.5 mol/l. Ich nehme mal zweiteres an, dann sind in 100 ml genau 50 mmol von beidem drin.
Was passiert, wenn Du eine kleine Menge, z.B. 1 mmol Säure oder Base zugibst? Naja, aus dem Säure/Acetat 100:100 wird dann 51/49 bzw. 49/51. Das neue Konzentrationsverhältnis verschiebt den pH ein bißchen, mit Henderson–Hasselbalch kannst Du auch ausrechnen wie viel. Du bekommst also zwei pH-Verschiebungen ΔpH, die (weil die Menge an zugegebener Säure/Base sehr klein war) fast symmetrisch sein sollten.
Naja, und die Pufferkapazität ist einfach Δn/ΔpH, also das Verhältnis zwischen pH-Verschiebung und Stoffmenge. Fertig.
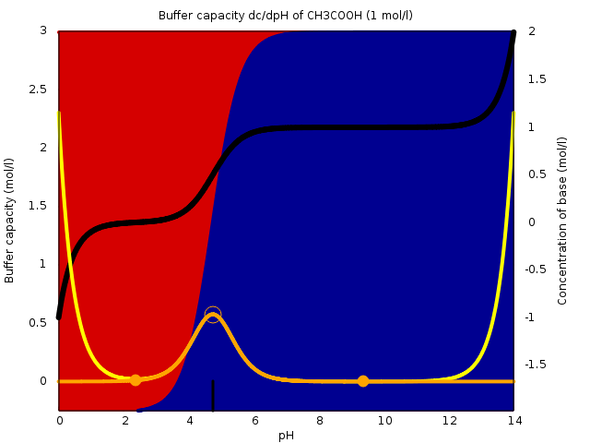
In der Praxis ist die Pufferkapazität natürlich pH-abhängig. Wie das aussieht, zeige ich auf dem angehängten Bild. Die Pufferkapazität (bezogen auf einen Liter) ist die linke Skala, gelbe Kurve (die orange Kurve ist der Anteil der Essigsäure, die gelbe berücksichtig zusätzlich den Beitrag des Wassers. Der Konzentrationsbereich, der Dich interessiert, ist das orange Maximum und da spielt der Wasseranteil keine Rolle).