Molare Masse umwandeln?
Hallo kann mir jemand helfen?Ich versteh das Thema in Chemie einfach nicht.Es geht um Mol, Molare Massen und wie man diese umrechnet in die Einheit u
2 Antworten

Moin,
das ist doch gar nicht so kompliziert...
Schau mal: Ein Atom ist ein irrsinnig kleines Ding. Trotzdem hat es eine Masse. Aber die Masse eines einzelnen Atoms ist wieder sooooo klein, dass man sie mit unseren üblichen Messinstrumenten wie zum Beispiel einer Waage nicht wiegen kann.
Aber weil jedes einzelne Atome eine Masse hat, ist es doch auch logisch, dass zwei gleiche Atome dann die doppelte Masse haben. Und drei gleiche Atome wiegen dann das dreifache. Und 1.000 Atome haben die 1.000-fache Masse. Das ist doch unmittelbar einsichtig, oder?
Dann ist doch auch klar, dass du irgendwann in einen Bereich der Masse kommst, die man auch mit unseren groben Messinstrumenten messen kann. Es kommt eben nur darauf an, dass man genügend Atome desselben Typs zusammen bringt.
Das ist logisch, oder?
Jetzt zu dem Zusammenhang zwischen der atomaren Masseneinheit u, dem Mol und der molaren Masse M.
Wie gesagt, ist ein einzelnes Atom ungemein klein und deshalb auch seeeehr leicht. Ein einzelnes Wasserstoffatom wiegt zum Beispiel etwa
1,672 (621) · 10^−27 kg.
Oder (als Dezimalzahl geschrieben): 0,000000000000000000000000001672... kg.
Diese Zahl ist ziemlich unhandlich, nicht wahr?! Damit will man nicht ständig zu tun haben. Deshalb hat man sich für Massen auf atomarem Niveau ein neues Bezugssystem ausgedacht, die atomare Masse mit der Einheit u.
Dabei hat man gesagt, dass ein Proton (das ist ein Atombaustein im Kern) ungefähr die Masse von 1 u hat. Desgleichen ist auch die Masse von einem Neutron (noch ein Atomkernbaustein) etwa 1 u. Die Masse der Elektronen ist noch einmal etwa 1837-mal kleiner (also 1/1837 u). Deshalb werden bei der Bestimmung der Masse einzelner Atome die Elektronen in der Regel nicht berücksichtigt, weil sie im Vergleich zu den Protonen und Neutronen nahezu unbedeutend sind.
Um noch einmal auf das Wasserstoffatom zu kommen. Es besteht aus einem Proton im Kern und einem Elektron in der Hülle. Da das Elektron massentechnisch nicht berücksichtigt wird, hat ein Wasserstoffatom folglich die Masse von etwa 1 u. Du kannst also sagen, dass 1,672 • 10^–27 = 1 u ist. Und gib es zu, 1 ist eine viel sympathischere Zahl als 0,000000000000000000000000001672...
Ein Mol ist wiederum einfach eine Zahl. Oder eine bestimmte Anzahl. Um den Begriff Mol besser zu verstehen, hilft dir vielleicht ein anderes (vertrauteres) Beispiel. Vielleicht kennst du den Begriff Dutzend?! Auch das Dutzend bezeichnet eine bestimmte Anzahl, nämlich 12. Immer wenn du von einem Dutzend sprichst, meinst du zwölf Stück von irgendetwas.
Zwölf Eier sind ein Dutzend Eier. Zwölf Autos sind ein Dutzend Autos. Sechs Menschen sind ein halbes Dutzend Menschen, verstehst du?
Tja, und das Mol ist eben ein Ausdruck für eine andere Anzahl, nämlich für ungefähr 6 • 10^23 oder wieder als Dezimalzahl ausgedrückt:
600.000.000.000.000.000.000.000 Stück.
Immer wenn du 6 • 10^23 Stück von irgendetwas hast, sind das ein Mol. 6 • 10^23 Eier sind ein Mol Eier. 6 • 10^23 Autos sind ein Mol Autos. 3 • 10^23 Menschen sind ein halbes Mol Menschen...
Der grundsätzliche Gedanke dahinter ist der gleiche wie bei der atomaren Masse. Weil 6 • 10^23 eine sooo große und unhandliche Zahl ist, hat man ein neues Bezugssystem eingeführt und spricht stattdessen lieber von Mol. Und auch hier musst du zugeben, dass 600.000.000.000.000.000.000.000 (Stück) eine viel blöder zu schreiben Zahl ist als 1 (Mol)...
Und jetzt kommt's: Der Clou an der Sache ist nun, dass du immer, wenn du etwa 6 • 10^23 Teilchen auf atomarem Niveau zusammen bringst (als 1 Mol davon), dann haben diese Teilchen zusammen dieselbe Masse in Gramm, wie die Summe der einzelnen Atome der Teilchen. Hmm, klingt komplizierter als es ist.
Nimm wieder den Wassersoff als Beispiel: Ein Wasserstoffatom hat die atomare Masse von 1 u. In elementarem Wasserstoff treten aber als kleinste Teilchen keine einzelnen Wasserstoffatome auf, sondern zweiatomige Minimoleküle; deshalb auch H2. Wenn ein Atom die atomare Masse von 1 u hat, dann hat das Minimolekül H2 logischerweise die doppelte atomare Masse, also 2 u.
Tja, und wenn du zwei dieser H2-Minimoleküle hast, ergibt das eine atomare Masse von 4 u. Bei einem Dutzend H2-Minimolekülen ergibt das eine Gesamtmasse von 48 u (12 • 2, du verstehst?!). Und wenn du ein Mol H2-Moleküle zusammen bringst, dann ergibt sich die molare Masse von - halt dich fest! - 2 g!!
Nun zu der Tabelle:
1 Stickstoffatom hat die atomare Masse von 14 u (das kommt übrigens daher, dass Stickstoffatome üblicherweise 7 Protonen und 7 Neutronen in ihrem Atomkern haben. Da sowohl das Proton als auch das Neutron etwa 7 u wiegen, ergibt das zusammen die atomare Masse von 14 u). Aber die kleinsten Teilchen in einem elementaren Stickstoffgas sind wieder keine einzelnen Atome, sondern (wie beim Wasserstoff) zweiatomige Minimoleküle: N2. Ein solches Minimolekül wiegt daher (2 • 14 =) 28 u. Dann wiegt ein Mol Stickstoff 28 g/mol:
1 Molekül N2: 28 u bedeutet 28 g/mol...
Bei Sauerstoff ist es dasselbe wie bei Wasserstoff oder Stickstoff:
1 O-Atom : 16 u, 1 O2-Molekül: 32 u heißt 32 g/mol.
Bei Natrium ist das anders. Die kleinsten Teilchen in einer Natriumportion sind einzelne Natriumatome. Daher gilt
1 Na-Atom: 23 u bedeutet 23 g/mol.
Du solltest folgendes auswendig lernen (falls du das nicht bereits weißt): Die kleinsten Teilchen in fast allen Elementen sind einzelne Atome. Bei diesen gilt dann logischerweise
Atomare Masse x u bedeutet molare Masse x g/mol.
Ausnahmen von dieser Regel sind folgende sieben Elemente
Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2) sowie die vier Halogene Fluor (F2), Chlor (Cl2), Brom (Br2) und Iod (I2).
Ein Sonderfall ist dann noch einmal Schwefel (S). Hier kommt es auf deine Lehrkraft an. Traditionell wird auch Schwefel zu den Elementen gezählt, deren kleinste Teilchen einzelne Atome sind. Dann gilt:
Atomare Masse S: 32 u bedeutet 32 g/mol.
Etwas moderner ist die Ansicht, dass die kleinsten Teilchen in einer Schwefelportion keine einzelnen Atome, sondern kleine Ringe aus 8 Schwefelatomen sind. Dann gilt:
Atomare Masse von S8: 256 u bedeutet 256 g/mol.
Den Rest mache ich dir am Beispiel Wasser vor. Dann schaffst du die übrigen Aufgaben bestimmt alleine (ich glaube an dich!):
Ein Molekül Wasser (H2O) besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Also bringt dieses Molekül auch die Masse dieser drei Atome zusammen auf die Waage, also (1 u + 1 u + 16 u =) 18 u. Und das bedeutet für die molare Masse: 18 g/mol. Einfach, oder.
Und nu Du!
LG von der Waterkant

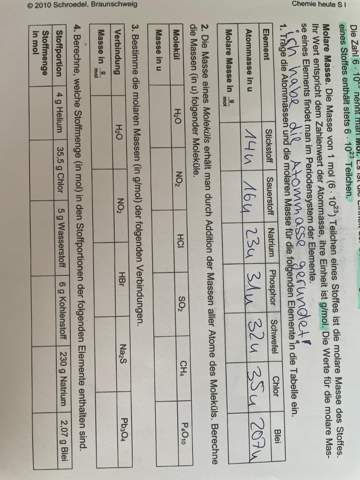
Nehmen wir von Aufg. 1 mal den Sauerstoff. Die molare Masse entspricht dem Zahlenwert der Atommasse, so steht es in der Aufgabe. Du weißt die Atommasse ja schon und brauchst also nur eine andere Einheit dahinter zu schreiben, also 16 g/mol.
Von Aufg. 2 und 3 nehmen wir mal das Wasser H2O. Der Zahlenwert ist wieder beide Male der gleiche, nur ist die Einheit einmal u und einmal g/mol. Den Zahlenwert erhältst Du durch Zusammenzählen der Werte für jedes der Atome in dem Molkül, also zwei mal Wasserstoff und einmal Sauerstoff.
Hier ist die Lösung (in g/mol) für das Wasser...
https://de.wikipedia.org/wiki/Molare_Masse#Berechnung
...und hier wird sie (in u) erklärt:
https://de.wikipedia.org/wiki/Molek%C3%BClmasse#Beispiel
Für Aufg. 4 berechne für jeden der Stoffe zuerst die Molekülmasse in g/mol, und dann teile die angegebene Menge durch die Molekülmasse. Du bekommst so heraus, wie viel mol von dem Stoff die angegebene Menge enthält.

Das ist noch wichtig zu wissen: Was ist ein Mol eines Stoffes? Das ist die Menge dieses Stoffes, die eine bestimmte feste Zahl von Molekülen enthält (oder, bei Elementen: eine bestimmte feste Zahl von Atomen). Diese bestimmte feste Zahl ist die Avogadro-Zahl, etwa 6 mal 10 hoch 23, wie in der Aufgabe angegeben ist. Ein Mol Sauerstoff hat also genau so viele Atome wie ein Mol Stickstoff und wie ein Mol Wasserstoff. Man kann auf diese Weise leichter berechnen, wie viel man von den Stoffen benötigt, um eine bestimmte Verbindung herzustellen.