Lösung zum Arbeitsblatt Lewis-Formel und Oktettregel?
Hallo, hätte jemand die Lösung zu diesem Arbeitsblatt. Wäre sehr hilfreich.
Vg!
1 Antwort

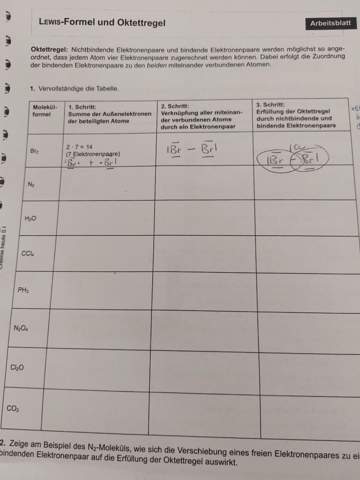
Das ist eigentlich nicht schwierig, du musst dir einfach erstmal links das Molekül/die Summenformel anschauen, bspw. Steht da beim nächsten N mit einer 2 im Index, der Index zeigt an, wie viele Atome es von dem Atom vor der Zahl gibt (also beispielsweise H2O hat 2 Wasserstoff Atome und 1 Sauerstoff Atom), also weiter zum N2, dort musst du einen Blick in dein Periodensystem werfen und dann siehst du, dass N (ich weiß es gerade nicht sicher, aber ich glaube in der 5. Oder 6. Hauptgruppe steht), jede Hauptgruppe steht für ein Valenzelektron (Also Elektron, welches außen am Atom dran ist und sich verbinden kann), also die Atome der ersten Hauptgruppe haben eins, die aus der 2. 2 usw., dadurch, dass wir (angenommen N, was übrigens Stickstoff ist steht in der 5. Hauptgruppe) 2 N-Atome haben haben wir insgesamt 10 Elektronen, jedes Atom (außer Wasserstoff) möchte jedoch insgesamt 8 Elektronen haben, also müssen die beiden Atome sich Elektronen teilen, dadurch entstehen Bindungen, bei N hat jedes Atom dann ein Elektronenpaar bei sich und sie haben eine Dreifachbindung zueinander, also drei elektronenpaare liegen zwischen den beiden Atome, dadurch hat jedes Atom 2+6 Elektronen der Bindung, insgesamt 8 Elektronen (alle Elektronen einer Bindung werden beiden Atome zugerechnet)
