Kann mir jemand diese Notizen erklären ( Säuren und Basen)?
Hallo, kann mir jemand diese Notiz vom Chemie erklären .an dem Tag war ich krank deswegen verstehe ich nicht..
kann mir das bitte jemand erklären, weil ich diese Stichworte /alles nicht verstehe..
Es geht um Säuren und Basen /Was der Unterschied ist
Redoxreaktion:

Neu:


.

.
Neu

Neu Aromastoffen:

3 Antworten

Naja, diese Notizen sind eine Gegenüberstellung der beiden Säure-Base-Theorien, die in ihren Grundzügen oben in den Notizen drin stehen. Das hat erst mal auch nicht viel mit verstehen zu tun, sondern muss man einfach lernen.
Interessant wird es, wenn die Theorie auf bestimmte Fallbeispiele angewandt wird.
Das Fallbeispiel Ammoniak ist dabei tatsächlich sehr popular, um die teils gravierenden Unterschiede zu erklären. Ammoniak ist eine starke Base, das schlägt sich in einem pH-Wert zwischen 8 und 14, je nach Konzentration der Ammoniak-Lösung, nieder.
Laut Arrhenius wird Ammoniak allerdings nicht als Base angesehen, da es nicht in Hydroxid-Ionen und Metallkationen dissoziiert. Laut Brønsted allerdings schon. Warum? Weil Ammoniak in der Lage ist, Protonen aufzunehmen, ist somit also Protonenakzeptor.



Naja, diese Notizen sind eine Gegenüberstellung der beiden Säure-Base-Theorien, die in ihren Grundzügen oben in den Notizen drin stehen. Das hat erst mal auch nicht viel mit verstehen zu tun, sondern muss man einfach lernen.
Interessant wird es, wenn die Theorie auf bestimmte Fallbeispiele angewandt wird.
Das Fallbeispiel Ammoniak ist dabei tatsächlich sehr popular, um die teils gravierenden Unterschiede zu erklären. Ammoniak ist eine starke Base, das schlägt sich in einem pH-Wert zwischen 8 und 14, je nach Konzentration der Ammoniak-Lösung, nieder.
Laut Arrhenius wird Ammoniak allerdings nicht als Base angesehen, da es nicht in Hydroxid-Ionen und Metallkationen dissoziiert. Laut Brønsted allerdings schon. Warum? Weil Ammoniak in der Lage ist, Protonen aufzunehmen, ist somit also Protonenakzeptor.

Kannst du dann bitte diese Notiz so in Sätzen schreiben ,damit ich es lernen kann..weil das ist mir so unübersichtlich..🙏🏻


Moin,
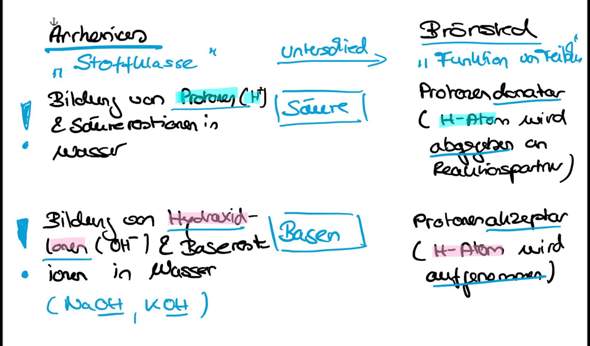
es geht um zwei Säure-Base-Theorien, nämlich einmal die von Arrhenius und dann die von Brønsted (eingedeutschte Schreibweise Brönsted, wobei auch noch Lowry weggelassen wurde, der unabhängig von Brønsted etwa zeitgleich zu gleichen Erkenntnissen gelangt war).
Nach Arrhenius ist eine Säure ein Stoff, der in Wasser in ein Proton (H^+-Ion) und einen Säurerest (ein Säurerestanion) dissoziiert (zerfällt). Eine Base ist dagegen ein Stoff, der in Wasser in Hydroxidanionen (OH^–) und ein Basenrestkation dissoziiert.
Nach Brønsted (& Lowry) ist eine Säure ein Teilchen, das ein Proton (H^+-Ion) abspalten kann (ein Protonendonator ist), wohingegen eine Base ein Teilchen ist, das ein Proton (H^+) aufnehmen kann (ein Protonenakzeptor ist).
Die Säure-Base-Theorie von Arrhenius hat gegenüber der von Brønsted (& Lowry) gewisse Nachteile.
- Bei Arrhenius geht es um Stoffe, also um die Stoffklasse der Säuren und die Stoffklasse der Basen. Der Nachteil dieser Sichtweise ist, dass man jedes Mal einen bestimmten konkreten Stoff untersuchen muss, um feststellen zu können, ob er sauer oder basisch reagiert. So müsste man das bei Arrhenius beispielsweise für Natriumhydrogensulfat (NaHSO4) und Kaliumhydrogensulfat (KHSO4) zweimal prüfen, weil es zwei Salze und damit zwei Stoffe sind (dazu später mehr).
- Die Sichtweise von Arrhenius ist an das Lösungsmittel Wasser gebunden, denn seine Definitionen beziehen sich in beiden Fällen explizit auf das Verhalten eines konkreten Stoffes in Wasser! Eine Säure-Base-Reaktion in der Gasphase könnte Arrhenius somit nicht interpretieren.
- Nach Arrhenius dissoziiert eine Base in Wasser in Hydroxidanionen (OH^–). Damit kann Arrhenius zwar wunderbar den basischen Charakter von Hydroxiden erklären, da sie die Hydroxidanionen ja mitbringen. Aber die basische Eigenschaft von Stoffen, die selbst keine Hydroxidanionen enthalten, wie zum Beispiel bei Ammoniak (NH3) oder Natriumcarbonat (Na2CO3), bleibt in dieser Säure-Base-Theorie eigentlich unerklärlich.
Die Säure-Base-Theorie von Brønsted (& Lowry) hat dagegen genau dort Vorteile, wo die von Arrhenius schwächelt.
Brønsted (& Lowry) verlassen die Stoffebene und betrachten stattdessen die Teilchenebene. Damit gehen sie weg von den Eigenschaften der Stoffe und rücken den Fokus auf die Funktion eines Teilchens in einer bestimmten Situation. Das wird dadurch erreicht, dass betrachtet wird, ob ein Teilchen ein Proton (H^+) abgeben oder aufnehmen kann.
Bei Brønsted (& Lowry) spielen also nur noch die Protonen (H^+-Ionen) eine zentrale Rolle. Die Hydroxidanion (OH^–-Ionen) sind dagegen höchstens dann noch interessant, wenn sie Protonen aufnehmen. Sie müssen nicht in einer Base enthalten sein, um diese als Base zu erkennen.
Und schließlich machen sich Brønsted & Lowry unabhängig vom Lösungsmittel Wasser, weil es in ihrer Vorstellung von Säuren und Basen nur darum geht, ob in einer bestimmten Reaktion von bestimmten Teilchen Protonen abgegeben oder aufgenommen werden, ganz unabhängig davon, in welchem Medium das passiert.
Brønsted & Lowry würden sowohl im Natriumhydrogensulfat (NaHSO4) als auch im Kaliumhydrogensulfat (KHSO4) die Hydrogensulfatanionen als Teilchen erkennen, die in der Lage sind, ein weiteres Proton abzugeben (und damit als Säure zu reagieren) oder ein Proton aufzunehmen (und damit als Base zu fungieren). Das hängt damit ganz vom Reaktionspartner ab. In Wasser (um es mit Arrhenius vergleichen zu können) gäben Hydrogensulfatanionen (HSO4^–) ihr letztes Proton ab, so dass nach Brønsted & Lowry sofort klar würde, dass alle wasserlöslichen Hydrogencarbonate in Wasser wie Säuren reagieren, ohne dass man das für jeden Einzelfall prüfen müsste. Das ist der Vorteil der Funktionssichtweise eines Teilchens gegenüber der Eigenschaft eines Stoffes.
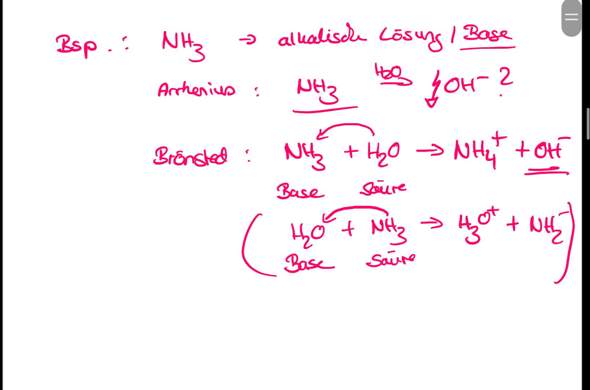
Und das alles habt ihr dann am Beispiel von Ammoniak (NH3) einmal exemplarisch durchgespielt.
Wenn du Ammoniak in Wasser gibst, entsteht eine basische (alkalische) Lösung. Das wusste auch Arrhenius. Aber das ist mit der Arrhenius-Vorstellung eigentlich nicht erklärbar, weil Ammoniak selbst gar keine Hydroxidanionen (OH^–) enthält, in das es im Wasser dissoziieren könnte. Aber in basischen (alkalischen) wässrigen Lösungen liegen Hydroxidanionen vor. Wo kommen die her?
Mit der Brønsted-Lowry-Säure-Base-Theorie ist das leicht erklärbar: Die Ammoniak-Moleküle sind offenbar in der Lage, Protonen aufzunehmen (zu akzeptieren). Und die Wasser-Moleküle sind offenbar in der Lage, ein Proton abzugeben. Dadurch entsteht folgende Reaktion:
NH3 + H2O ---> NH4^+ + OH^–
Das Wassermolekül reagiert Ammoniak gegenüber wie eine Säure, weil es ein Proton abgibt (es ist ein Protonendonator).
Das Ammoniakmolekül reagiert gegenüber Wasser wie eine Base, weil es ein Proton aufnimmt (es ist ein Protonenakzeptor).
Somit wird klar, warum auch Ammoniak eine Base ist (obwohl es selbst keine Hydroxidanionen enthält).
Rein theoretisch (und deshalb in Klammern) wäre es auch denkbar, dass Ammoniak an Wasser ein Proton übergibt. Dann würden Oxoniumionen (H3O^+) und Amidanionen (NH2^–) entstehen. Oxoniumionen sind aber das typische Kennzeichen von sauren Lösungen. Da eine ammoniakalische wässrige Lösung aber basisch (alkalisch) und nicht sauer reagiert, ist diese letzte Reaktion offensichtlich nur theoretischer Natur.
Damit dürften die von dir geposteten Stichpunkte alle ausführlich erklärt sein.
LG von der Waterkant
