Chemie - kann mir jemand dieses Molekül erklären (SO2)?
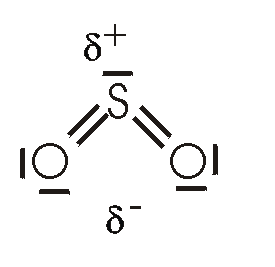
Auf dem Bild ist es zu sehen (SO2) Nach dieser Strukturformal müsste Schwefel doch die Edelgaskonfiguration überschritten haben. Ein freies Elektronenpaar und 4 Elektronenpaarbindungen, das ergibt 10 Elektronen. Ist soetwas möglich oder wie ist das zu erklären?
3 Antworten

Hi,
du hast Recht und meine Vorredner, die von Sechs Elektronen reden, haben leider Unrecht. Ein ungebundenes Schwefelaton hat sechs Elektronen auf der Außenschale.
Das hat mit der Mesomerie zu tun. Eigentlich hast du nämlich nicht diese vier Bidungsstriche, sondern ein Elektronenpaar "hüpft hin und her" - das nennt man Mesomerie. Du hast hier so ein "Zwischending", was man auch mesomeren Zustand nennt. Hier gibt es dann zwei mesomere Grenzformeln, das sind die Strukturformeln, die je eine Möglichkeit der Elektronenverteilung hier an gibt. Siehe das Bild weiter unten:
https://de.wikipedia.org/wiki/Schwefeldioxid
Hier noch etwas zur Mesomerie:
https://de.wikipedia.org/wiki/Mesomerie
Ich hoffe, ich habe das richtig erklärt - ich kriege das erst im kommenden Semester.
LG

Richtig. Es gibt tatsächlich Chemiker, die (wie ich) diese "Oktettüberschreitung" auch bei größeren Atomen nicht für richtig halten (was auch durch neuere Untersuchungen gestützt wird) und deshalb SO2 als Zwitterion schrieben: Eines der bindenden e-Paare zum O, dort neg. Ladung, am S positive. Es gibt dabei zwei spiegelbildliche Formen, die als mesomere Grenzformeln anzusehen sind.


Die Zählweise zur Oktettregel ist so: Alle Striche (Elektronenpaare), egal ob bindend oder nichtbindend, werden jedem beteiligten Atom zugeschlagen. Daher haben die beiden O-Atome je ein Oktett, der Schwefel aber ein Dezett.
Darf er das? Ja, das geht (in H₂SO₄ hat er sogar ein Dodezett: Zwei Doppelbindungen zu den terminalen Sauerstoffen, zwei Einfachbindungen zu den OH-Gruppen). Alle Elemente ab der dritten Periode dürfen das, weil sie größer sind als die der zweiten Periode und daher mehr Elektronenpaaren Platz bieten. Die Oktettregel gilt also strikt nur für B,C,N,O,F; bei den schwereren Elementen muß man sagen, daß die mindestens ein Okett wollen.
Man kann für SO₂ auch Strukturen zeichnen, die die Oktettregel strikt erfüllen, in denen der S also nur 8 Elektronen bekommt. Allerdings muß man dann Formalladungen zulassen.
Das habe ich erst vor zwei Tagen in absurder Ausführlichkeit durchdiskutiert:
https://www.gutefrage.net/frage/frage-zur-wertigkeit-von-atomen#answer-188253905
"Zwitterion" - ein sehr schöner Begriff! ;-)