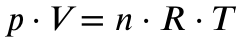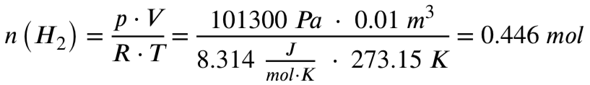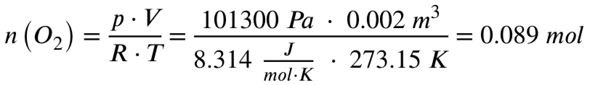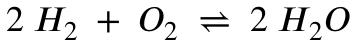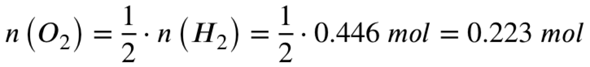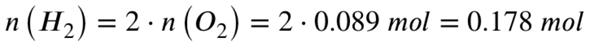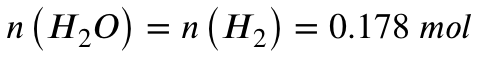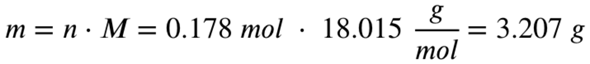Bei der Reaktion von Wasserstoff mit Sauerstoff werden bei Normbedingungen 10 Liter Wasserstoff mit 2 Liter Sauerstoff. Berechne Masse entstehendes Wasser ?
Ich weiß nicht wie ich chemisch rechne stöchiometrisch
1 Antwort

Als erstes musst du mit Hilfe der idealen Gasgleichung aus dem Volumen die Stoffmengen der beiden Gase errechnen:
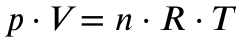
Es gilt für
p = Druck in Pascal (ich gehe von Normaldruck aus, 1013 hPa, also 101300 Pa)
V = Volumen in Kubikmeter (gegeben, 10 Liter und 2 Liter)
n = Stoffmenge in mol (gesucht)
R = Ideale Gaskonstante (8,314 J/mol*K)
T = Temperatur in Kelvin (ich gehe von Normaltemperatur aus, 0 Grad Celsius, also 273,15 K)
Einsetzen ergibt dann:
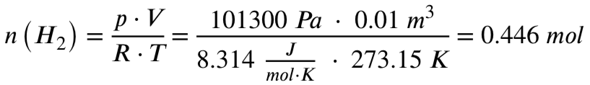
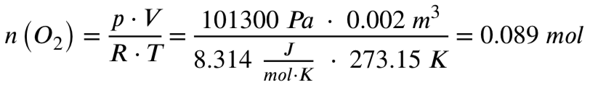
Jetzt benötigen wir die Reaktionsgleichung:
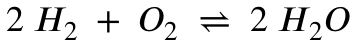
An der Reaktionsgleichung erkennt man, dass das Stoffmengenverhältnis zwischen Wasserstoff und Sauerstoff 2:1 ist.
Für den Fall, dass alles Wasserstoff, also 0,446 mol, reagiert, wäre die dafür benötigte Stoffmenge an Sauerstoff:
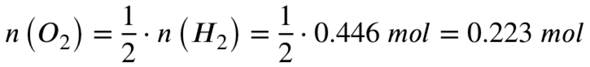
Wir haben aber nur 0,089 mol Sauerstoff vorliegen. Dieser wird vollständig umgesetzt, dafür benötigt es folgende Stoffmenge an Wasserstoff:
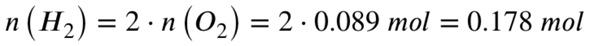
Also reagieren von den 0,446 mol Wasserstoff nur etwa 0,178 mol, da für eine vollständige Umsetzung der 0,446 mol Wasserstoff zu wenig Sauerstoff (nur 0,089 mol, obwohl 0,223 mol benötigt würden) vorhanden ist.
Aus der Reaktionsgleichung geht ebenfalls hervor, dass das Stoffmengenverhältnis von Wasserstoff und Wasser 1:1 ist (eigentlich 2:2, das ist gekürzt dasselbe wie 1:1).
Für die Stoffmenge an entstehendem Wasser gilt also:
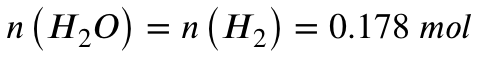
Es entstehen also 0,178 mol Wasser. Mit der molaren Masse von Wasser lässt sich hieraus nun die Masse des entstehenden Wassers berechnen:
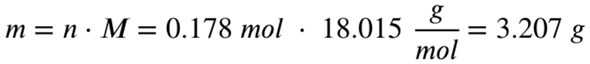
Die Masse des entstehenden Wassers beträgt also 3,207 Gramm.
Anmerkung:
Man kann die Stoffmengen der beiden Gase auch über das molare Volumen ausrechnen. Darüber sollte man nahezu die gleichen Ergebnisse, mit eventueller Abweichung in der 3. oder 4. Nachkommastelle erhalten. Das reicht für die meisten Berechnungen vollkommen aus.
Ich persönlich rechne nur lieber mit der idealen Gasgleichung, da dort auch Temperatur und Druck einen Einfluss haben.