Auswertung von 1H-NMR-Spektren - wie analysiere ich die Multipetts?
Guten Morgen,
momentan bereite ich mich auf meine Klausur in empirischer Spektroskopie vor. Eigentlich habe ich das Prinzip der NMR-Auswertung gut verstanden, bei einer Aufgabe stehe ich jetzt vor mehreren Problemen:
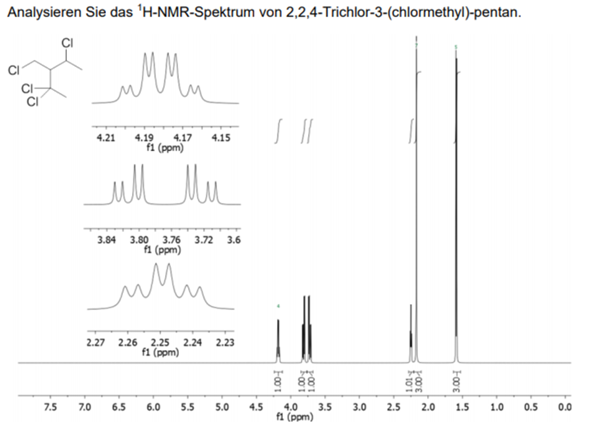
Das Singulett bei δ = 1.5 ppm kann man ja klar der Methylgruppe unten zuordnen, da die Chloratome am benachbarten C-Atom die Protonen abschirmen.
Das Multiplett bei δ = 2.27 ppm habe ich als ein Triplett vom Duplett interpretiert, was zu dem Proton am tertären C-Atom passen würde.
Das Multiplett bei δ = 4.18 ppm habe ich als Quartett vom Duplett interpretiert, was zu dem Proton an dem C-Atom passen würde, das ein H-Atom, ein Chloratom und eine Methylgruppe gebunden hat.
Das ist alles schön und gut, das Signal bei δ = 3.75 ppm kann ich allerdings nicht zuordnen. Das müsste dann zwar rein logisch dem CH2Cl zugeordnet werden - was auch von der chemischen Verschiebung passt - ich verstehe aber nicht, wieso. Koppeln die H-Atome jeweils mit dem anderen H-Atom an dem C und mit dem Proton am tertiären C-Atom?Ich bin mir nicht sicher, ob die Kerne enantiotop oder diastereotop sind. Bei enantiotopen Protonen hätten wir ja die gleiche chemische Verschiebung...das ist ja nicht ganz der Fall. Das wäre die erste Frage.
Weiterhin frage ich mich oft, wie ich die Multipletts auch so erkenne. Hier hatte ich das Molekül ja jetzt gegeben, das heißt, bei vielen Multipletts konnte ich mir das anhand der benachbarten Protonen und der chemischen Verschiebung zusammenreimen. Wenn ich aber nur Multipletts habe bzw nur das 1H-NMR (evtl. mit zusätzlichem 13C-NMR) vorliegt, weiß ich oftmals nicht, wie ich die Multipletts interpretieren soll:
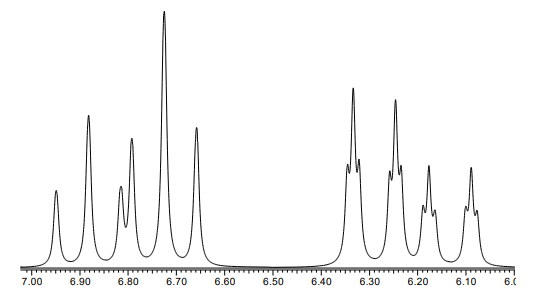
Hier wäre ich komplett aufgeschmissen, vor allem, was auch noch das Einzeichnen der Kopplungskonstanten betrifft. Durch δ kann ich mir maximal ableiten, dass es sich um einen Aromaten handelt, beim rechten Multiplett könnte ich nicht mal raten, was das für ein Multiplett ist. Wie gehe ich bei sowas vor? Das Spektrum gehört zum Molekül 4-Phenyl-but-2-en-1-al.
Entschuldigt die lange Frage. Es wäre super, wenn mir jemand helfen könnte, die Klausur ist in drei Wochen und ich würde das bis dahin gern verstanden haben.
LG
1 Antwort

Ich probiere es, aber sei vorsichtig, ich bin völlig aus der Übung.
Als erstes numerieren wir die Atome — die CH₃-Gruppe unten ist C¹, die Hauptkette zieht sich bis zur CH₃-Gruppe rechts oben (C⁵), und die CH₂Cl-Seitenkette nenne ich α. Da das C² keine Wasserstoffatome trägt, erwarten wir fünf Signale. Und die sehen wir auch, bei δ= 1.6, 2.15, 2.25, 3.76 und 4.18. Ich numeriere sie von #1 bis #5.
Die CH₃-Gruppen sind leicht zu finden, anhand der Integrale sehen wir, daß das die am wenigsten verschobenen Signale sind. C¹H₃ ist das unaufgespaltene Signal #2 bei δ=2.15 ppm, und C⁵H₃ liegt bei 1.6 (#1) und scheint ein Dublett zu sein. Die Verschiebungen entsprechen den Erwartungen: C¹ hat zwei Chlornachbarn am C² und wird deshalb stärker verschoben als C⁵ mit nur einem Cl-Nachbarn. Die Aufspaltungen passen auch: C⁵ hat einen H-Nachbarn (→Dublett), C₁ hat keinen (→Singulett).
Bleiben die Hs an den Kohlenstoffen 3, 4 und α, die wir den Signalen #3, #4 und #5 zuordnen müssen.
Das tertiäre C³H muß die #3 (δ=2.25) sein; es hat kein geminales Chlor wie die anderen beiden und ist daher weniger verschoben, und die Struktur sieht grob so aus, als ob es rechts einen (enges Dublett) und rechts zwei (weiteres Triplet) H-Nachbarn hätte; wirklich schön ist es aber nicht, sondern ekelig verbreitert. Warum, sehen wir später, wenn wir zum α kommen.
Das C⁴H schlägt als #5 bei δ=4.18 auf, die Multiplettstruktur ist konsistent mit drei H-Nachbarn rechts (am C⁵) und einem links (am C³).
So, und jetzt bleibt das Ferkel #4 (δ=3.76) übrig. Offenbar ist das kein Multiplett, sondern es sind zwei verschiedene Signale von zwei verschiedenen Protonen, denn die Abstände zwischen den 4 Signalgruppen sind nicht gleichförmig (in der Mitte größer als am Rand). Also sind das zwei verschiedene Protonen mit fast gleichem δ, die durch Kopplung zu einem Dublett vom Dublett zerlegt werden. Es handelt sich natürlich um die beiden Protonen am α-C, und die eine Kopplung haben sie miteinander (deshalb steigt die Signalintensität der inneren Dubletts gegenüber den äußeren an und täuscht ein Quartett vor), die andere mit dem H am C³.
Warum besteht diese Methylengruppe aus zwei chemisch verschiedenen H-Atomen? Tja, Stereochemie! Die beiden Hs sind im räumlichen Molekül niemals gleichwertig, das eine ist immer näher am C² als am anderen, deshalb fühlen sie unterschiedliche Abschirmung. Das sollte sich über die innere Rotation um die Cα–C³-Bindung herausmitteln, aber vielleicht handelt es sich um ein Tieftemperatur-NMR, bei dem die innere Rotation eingefroren wurde, oder die vielen Chlors hemmen die interne Rotation mehr als man erwarten würde. Deshalb ist auch die Triplett-Kopplung bei #3 (C³) so verwaschen, weil die zwei Nachbarn am α eben nicht wirklich identisch sind.
Nimm das bitte mit dem berühmten granum natrii chlorati, denn das letzte Mal, daß ich sowas gemacht habe, war während des Studiums also ≈1991.

P.S.: Dein Monster zwischen 6 und 7 ppm halte ich für einen Ortho-substituierten Aromaten, entsprechend der Regel, daß para hübsch aussieht, meta gräßlich und ortho irgendwo dazwischen — aber mehr kann ich dazu nicht beitragen, und vielleicht stimmt es auch gar nicht.