Wie richte ich Reaktionsgleichungen ein?
Hi! Ich bin echt schlecht in Chemie, ich verstehe dieses Fach einfach nicht :‘(
Mein Problem ist jedenfalls, dass ich Morgen eine Chemiearbeit schreibe und ich schon seit Tagen an dieser Aufgabe sitze. Ich habe meinen Lehrer schon sehr oft gefragt, jedoch verstehe ich es immer wieder nicht.
Das einzige was ich verstehe ist, dass auf jeder Seite gleichviel Atome sein müssen und das man etwas verdoppeln muss.
Nur so nebenbei, ich bin in der 8. Klasse und das ist mein erstes Jahr in Chemie, was heißt ich habe noch nicht soviel Vorwissen. Ich würde darum bitten etwas darauf zu achten :) Aber ich weiß was das Reaktionsschema bedeutet, also was die Buchstaben heißen, wenigstens ein Anhaltspunkt haha
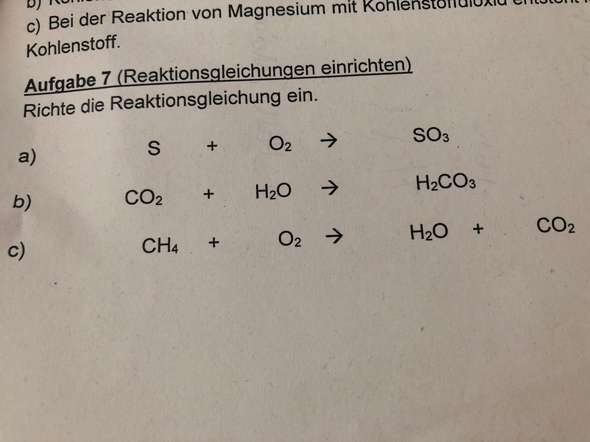
z.B. bei der Aufgabe a), dort ist ja ein Schwefel Atom (wenn man das so sagt?) + 2 Sauerstoff Atomen und das ergibt dann Schwefeltrioxid. Woher kommt aber die 3? Und was verdopple ich da? Außerdem sind manchmal vor den Buchstaben großgeschriebene Zahlen (z.B. 3FeS), was hat es damit auf sich?
Ich bitte um eine einfache und aber auch ausführliche Erklärung, danke im Voraus^^
3 Antworten
Also erstmal zur Notation. Eine tiefgestellte Zahl hinter einem Buchstaben heißt, dass dieser Buchstabe (bzw. das Element für das er steht) so oft in dem Molekül vorkommt. Beim SO3 wären das also 1 Schwefelatom und 3 Sauerstoffatome (kann die Zahlen hier leider nicht tiefstellen, stells dir einfach vor).
Eine Zahl vor einem Molekül heißt, dass das ganze Molekül so oft vorkommt. Also 1 SO3 ist ein Molekül Schwefeltrioxid. 2 SO3 sind entsprechend 2 Moleküle Schwefeltrioxid.
Wenn du jetzt eine Reaktionsgleichung ausgleichen sollst, so wie in dieser Aufgaben, dann darfst du nur die Zahlen vor den Molekülen verändern, aber nicht die tiefgestellten. Das würde sonst ein anderes Molekül ergeben.
In deinem Beispiel hast du jetzt folgendes dastehen:
S + O2 -> SO3 (in Worten: Schwefel reagiert mit Sauerstoff zu Schwefeltrioxid)
Nun hast du aber, wie unschwer zu erkennen ist, links 1 Schwefelatom und 2 Sauerstoffatome. Rechts dagegen 1 Schwefelatom und 3 Sauerstoffatome. Das heißt das Verhältnis der Stoffe zueinander passt nicht. Daher musst du jetzt die Anzahl der Moleküle/Stoffe ändern, um auf jeder Seite gleich viele Atome von jeder Sorte zu haben.
Rechts fehlt ein Sauerstoffatom. Wenn wir jetzt aber einfach links eine 2 vor das O2 schreiben, haben wir links wiederum ein Sauerstoffatom zuviel:
S + 2 O2 -> SO3
Also nehmen wir auch mal 2 vom SO3:
S + 2 O2 -> 2 SO3
Jetzt sind es wieder rechts zuviele O. Aber wenn wir einfach 3 O2 nehmen, dann kommen wir auf 6 auf der linken Seite. So viel stehen auch rechts. Also:
S + 3 O2 -> 2 SO3
Jetzt haben wir aber noch das neue Problem, dass rechts 2 Schwefelatome sind, links aber nur eines. Also müssen wir auch 2 vom S nehmen.
2 S + 3 O2 -> 2 SO3
Jetzt stehen auf beiden Seiten gleich viele Atome von jeder Sorte. Die Gleichung ist damit ausgeglichen und fertig.
Die wichtigste Erkenntnis hast du ja schon:
Links und rechts muss gleich sein.
VOR dem Atom/Molekül steht die gesamte Anzahl
a) -> Hier hast du die Hürde, dass Sauerstoff molekular, also als O2 vorkommt, jedes Schwefelatom also 1.5 Sauerstoffmoleküle zur Verbrennung braucht.
Das musst du jeweils links und rechts erweitern, um auf ganze Zahlen zu kommen.
Das funktioniert ähnlich wie mathematische Gleichungen.
In dem Falls 2S + 2O2 --> 2SO3
2 Atome Schwefel + 2 Moleküle (=4 Atome) Sauerstoff ergeben 2 Moleküle Schwefeltrioxid
Jedes Element hat bestimmte Wertigkeiten. z.B. Sauerstoff meistens -2-wertig.
Schwefel in dem Fall +6-wertig, kann aber auch in einigen anderen Wertigkeiten stabile Verbindungen eingehen.
Oh - war zu heiß für solche hochkomplexen mathematischen Aufgaben
3 Moleküle (=6 Atome) Sauerstoff
Danke für den Hinweis
Die 3 in SO3 liegt mehr oder weniger fest, jedenfalls wenn der Stoff bekannt ist. DIES kommt zB auch im Namen heraus Schwefeltrioxid, oder zB Kohlenstoffdioxid bei CO2.
Ansonsten benötigt man vor allem das kleinste gemeinsame Vielfache (kgV), wie beim Erweitern von Brüchen!
Wenn die Stoffe und Formeln bekannt sind, erweitert man so lange, bis auf beiden Seiten eben die gleiche Anzahl der jeweiligen Atome steht und passt dann den Rest an.
Bei A) O2 und SO3 muss man auf 6x O erweitern, also x3 und x2. Dann braucht man aber auch 2x S.
B) muss nicht erweitert werden. WENN man durchhält, erkennt man, dass es passt!
C) Aus 4 H werden 2 H2O. Dafür braucht man 2 O, also 1 O2.
Aus 1 C wird zu 1 CO2. Dafür braucht man auch 2 O, also 1 O2. Sind zusammen 2 O2.
Die Zahlen VOR den Formelnnsind die stöchiometrischen Faktoren, die für die ganze Formel gelten.
Die Indizes gelten nur für das Element davor!
Also H2O ist 2x H und 1x O
Aber 2 H2O sind 4x H und 2x O
Das kann nicht stimmen:
Links: 4 mal Sauerstoff
Rechts: 6 mal Sauerstoff