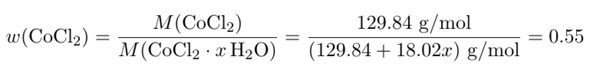Wie berechnet man, wie viel Mol Wasser in dieser Aufgabe?
wenn man 1 g rotes cobalt(II)-chlorid-hydrat erhitzt. bleiben 0,55 g blaues wasserfreies cobalt(II)-chlorid zurück. Wie viel mol wasser in einem mol dieses salzhydrates sind enthalten?
1 Antwort

Es gibt verschiedene Möglichkeiten, wie man das auswerten kann. Eine naheliegende ist es, den ganzen Schlunz in viele Einzelschritte aufzudröseln, aber ich wähle heute eine etwas ambitioniertere Methode.
Wasserfreies CoCl₂ hat eine molare Masse von M(CoCl₂)=129.84 g/mol. Wir haben ein unbekanntes Hydrat mit x Wassermolekülen pro CoCl₂-Formelenheit; dessen molare Masse können wir tentativ als M(CoCl₂ ⋅ x H₂O) = 129.84 + 18.02⋅x ansetzen. Außerdem wissen wir, daß der Massenanteil w(CoCl₂) im Hydrat 55% beträgt (weil von 1.00 g Hydrat genau 0.55 g wasserfreies Material übrigbleibt). Damit können wir eine Gleichung aufstellen:
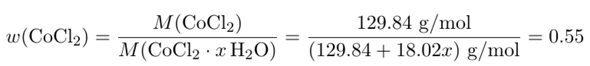
und die kann man leicht nach x auflösen; das Resultat ist x=5.9, also liegt ein Hexahydrat CoCl₂ ⋅ 6 H₂O vor.