Was ist eine Wasserstoffbrückenbindung?
3 Antworten

Was versteht man unter einer Wasserstoffbrückenbindung?
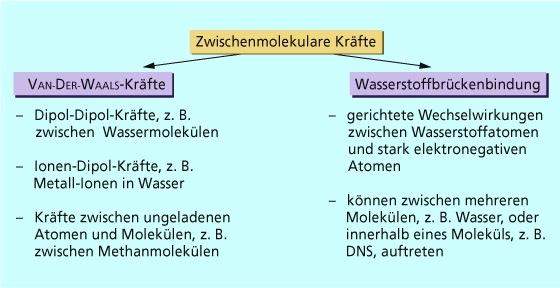
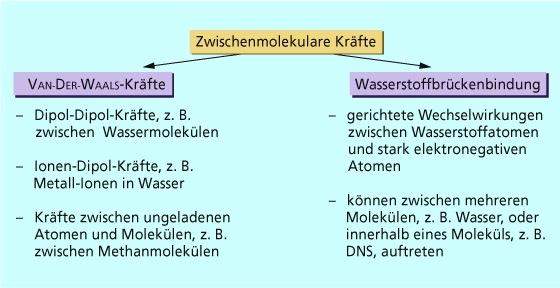
Wasserstoffbrückenbindungen entstehen zwischen Molekülen, in denen Wasserstoffatome an besonders stark elektronegative Atome (z. B. Fluor, Sauerstoff oder Stickstoff) gebunden sind. ... Ursache ist hier ebenfalls die Ausbildung von Wasserstoffbrücken zwischen den Alkoholmolekülen.
Wasserstoffbrückenbindungen in Chemie | SchülerlexikonWasserstoffbrückenbindung, auch kurz Wasserstoffbrücke oder H-Brücke, ist eine anziehende Wechselwirkung zwischen einem kovalent gebundenen Wasserstoffatom und einem freien Elektronenpaar eines in einer Atomgruppierung befindlichen Atoms. Wikipedia

Wasserstoffbrückenbindungen entstehen zwischen Molekülen, in denen Wasserstoffatome an besonders stark elektronegative Atome (z. B. Fluor, Sauerstoff oder Stickstoff) gebunden sind.
Die Atombindung zwischen stark elektronegativen Atomen und Wasserstoffatomen ist in hohem Maße polarisiert, da das Fluor-, das Sauerstoff- und das Stickstoffatom bindende Elektronenpaare besonders stark anziehen. An den kovalent gebundenen Wasserstoffatomen herrscht dadurch Elektronenmangel, sodass diese partiell positiv geladen sind und mit den freien Elektronenpaaren von anderen elektronegativen Atomen in Wechselwirkung treten.
Die Wasserstoffbrückenbindungen sind zwar schwächer als normale Atombindungen, beeinflussen aber die Eigenschaften des Stoffes gravierend. So wäre Wasser mit einer molaren Masse von 18 g/mol trotz des Dipolcharakters des Wassermoleküls nicht flüssig, wenn nicht viele Wassermoleküle untereinander durch Wasserstoffbrücken verbunden wären. Dadurch wird der Phasenübergang von flüssigem Wasser zu gasförmigem Wasserdampf erschwert.

Ein Maß für die Kraft, die Elektronen der Elektronenpaarbindung an sich zu ziehen, bezeichnet man als Elektronegativität (EN = Maß dafür, wie stark ein Atom gemeinsame Bindungselektronen anzieht). Unterschiedliche Atome weisen einen unterschiedlichen Elektronegativitätswert auf. Das Element mit der höchsten Elektronegativität ist Fluor (EN =4). Sauerstoff hat eine Elektronegativität von 3,5 und Wasserstoff von 2,1. Das wiederum hat Auswirkungen, wenn sich Atome zu einem Molekül zusammenfinden, wie das bei Wasser der Fall ist. Im Wassermolekül hat Sauerstoff also eine größere Elektronegativität als Wasserstoff und zieht damit die Elektronen der beiden Elektronenpaarbindungen an sich auf seine Seite. Somit ergibt sich für das Sauerstoffatom eine negative Teilladung (bezeichnet mit dem altgriechischen Buchstaben „delta“; δ-). Die Wasserstoffatome hingegen erhalten eine positive Teilladung (δ+).
Aus der gewinkelten Struktur und den unterschiedlichen Elektronegativitätswerten von Sauerstoff und Wasserstoff ergibt sich ein negativer Ladungsschwerpunkt auf der Seite des Sauerstoffs und ein postitiver Ladungsschwerpunkt auf der anderen Seite des Wassermoleküls beim Wasserstoff.
Wassermoleküle sind somit ein Dipol bzw. Dipolmolekül (Zweifachpol).

Ah, okay. Habe es direkt verstanden. Was ich aber auch nicht verstehe ist ein Dipol. Kannst du es mir bitte in einfachen Worten erklären?