Warum sind doppelbindungen energetisch ungünstig?
Ungesättigte Kohlenwasserstoffe sind zwar stabil, aber energetisch ungünstiger als gesättigte Kohlenwasserstoffe. Kann mir jemand erklären warum das so ist? Meine vermutung ist zwar wahrscheinlich maximal falsch aber einen versuch es trotzdem wert: wenn man eine bindung hat ziehen sich Atome gegenseitig an, dadurch wird energie frei, hat man eine doppelbindung so muss das doppelte an energie für die anziehung verwendet werden.
3 Antworten

Kohlenstoff-Einfachbindungen besitzen eine Bindungsenergie von 84 kcal/mol. Kohlenstoff-Doppelbindungen besitzen eine Bindungsenergie von 148 kcal/mol und sind damit insgesamt stärker.
Bei einer C-C-Einfachbindung ist die Ladungsverteilung der an der Bindung Beteiligten Valenzelektronen rotationssymmetrisch um die Bindungsachse verteilt. Die Hybridorbitale überlappen frontal. Das ist die σ-Bindung.
Bei einer Doppelbindung liegt nun eine σ-Bindung, sowie zusätzlich eine π-Bindung vor, bei der p-Orbitale lediglich seitwärts überlappen. Damit ist die Doppelbindung insgesamt stabiler als eine Einfachbindung, da beide eine σ-Bindung enthalten, aber die π-Bindung ist schwächer und es kann hier leichter zur Reaktion kommen.
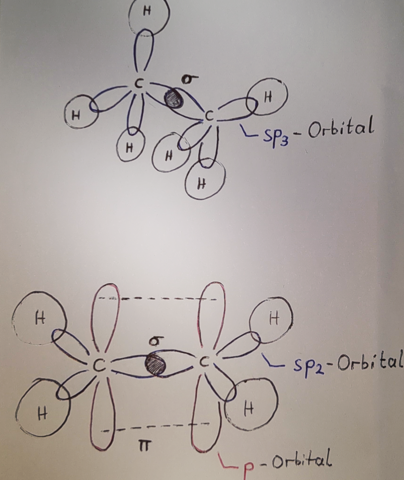
Abbildung: Oben Ethan mit einer Kohlenstoff-Einfachbindung und unten Ethen mit einer Doppelbindung.
Außerdem werden dann neue zusätzliche Bindungen gebildet, z. B. C-H-Bindungen, bei der Hydrierung von Alkenen. In der Regel kostet ein Bindungsbruch Energie und ein Bindungsaufbau setzt Energie frei.

Jein.
"... hat man eine doppelbindung so muss das doppelte an energie für die anziehung verwendet werden."
Man muss ETWA das Doppelte an Energie für die SPALTUNG aufbringen.
Umgekehrt bedeutet das, dass etwa das Doppelte an Energie frei wird, wenn sich die Doppelbindung bildet. Es ist also stabiler als eine Einfachbindung!
Aber: Eine Bindung der Doppelbindung lässt sich relativ leicht (mit wenig Energieaufwand) auftrennen. Stoffe mit C=C-Doppelbindung sind also reaktiver als solche mit Einfachbindung.
Schön wäre es, wenn du die Rechtschreibregeln auch richtig anwenden würdes.

Na ja, es wird eine Bindung gelöst, und zwei neue werden gebildet.