Warum erfüllt Stickstoff die Oktettaufweitung nicht, Phosphor aber schon?
Aus Sicht der Orbitale (siehe Bild):
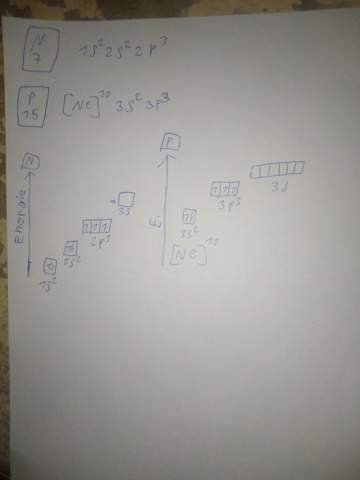
Ich verstehe diesen Text nicht, von Chemie.de: Oktetterweiterung (siehe Bild):

1 Antwort

In der 2. Schale gibt es noch keine d-Orbitale, daher kommen als Zusatzobitale nur die der 3. Schale in Frage. Die liegen energetisch einfach zu hoch und das 3s-Orbital hat zusätzlich noch eine ungünstige Geometrie um eine weitere Bindung einzugehen oder daran teilzuhaben, es ist ja kugelsymmetrisch.
Die Oktettaufweitung ab der 3. Periode durch Benutzung der 3d-Orbitale ist inzwischen sehr unstritten oder widerlegt. Um das beurteilen zu können, reichen meine Fähigkeiten in der Physikalischen Chemie nicht. Jedenfalls haben das neueste Berechnungen ergeben, die inzwischen wohl auch schon 20 oder 30 Jahre alt sind. Aber es dauert seine Zeit, bis sich das in Schulbüchern niederschlägt und Lehrerkreisen rumspricht.
Da sich die "wahren" Bindungsverhältnisse ohnehin nicht mit einer Lewisformel darstellen lassen, ist es eigentlich egal, wie viele Bindungen du einzeichnest. Also male ruhig 5 oder 6, z.B. beim PF₅⁻ oder SF₆.
Bleibt die Frage, warum das in der 2. Periode nicht geht, also z.B. NF₅ oder OF₆. Da tippe ich auf zu geringe EN-Differenzen und schlicht Platzmangel.