Warum ändert sich die Farbe nur am Äquivalenzpunkt?
Hallo, bei einer Titration mit Indikatoren sieht man eine Farbänderung nur dann, wenn der Äquivalenzpunkt erreicht wird. Aber was ist der Grund dafür?
Ich habe jetzt zwei Titrationen zum ersten Mal durchgeführt. Bis zum Äquivalenzpunkt sieht man eine kurze Farbänderung, wenn die Tropfen der Maßlösung die Oberfläche der zu bestimmenden Lösung treffen. Dann verschwindet die Farbe komplett und man sieht die Farbe der zu bestimmenden Lösung. Wieso vermischen sich die beiden Farben nicht mit der Zeit, statt auf einmal?
2 Antworten

Der gewählte Indikator für die Titration von Salzsäure mit Natronlauge ist beispielsweise Phenolphthalein. Dieser ist von einem pH-Bereich von 0 bis etwas 8.2 farblos, und ändert seine Farbe in einem pH-Bereich von 8.2 bis 12 zu rosa-violett.
Betrachten wir nun unsere Titration von 0.1 M Salzsäure mit 0.1 M Natronlauge. Anfänglich haben wir eine hohe Konzentration an Oxoniumionen, die mit der Zugabe von Natronlauge stetig abnimmt. Kurz vor dem Äquivalenzpunkt ändert sich nun der pH-Wert schlagartig, da die Oxoniumionen-Konzentration so gering ist, dass diese durch beispielsweise nur einen Tropfen 0.1 M Natronlauge wesentlich überkompensiert wird. Weswegen der pH-Wert schlagartig (Abbildung: Graph a) steigt.
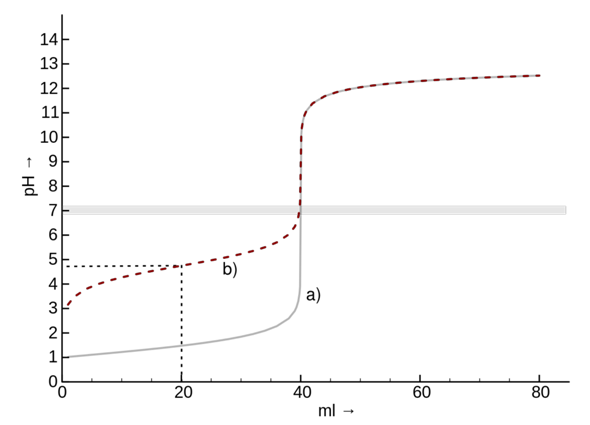
Dabei schlägt ab einem pH-Wert von 8.2 unser Indikator von farblos zu rosa-violett um.
Kurz vor dem Äquivalenzpunkt ist beim Eintropfen an der Eintropfstelle schon eine rosa-violette Verfärbung zu sehen. Dies ist darauf zurückzuführen, dass an der Eintropfstelle - je nach Rühren - kurzzeitig ein hoher pH-Wert, aufgrund der lokal hohen Hydroxidionen-Konzentration, vorliegt. Durch Rühren verteilen sich die Teilchen in der Lösung und der pH-Wert ist überall wieder nahezu identisch.
~Johannes
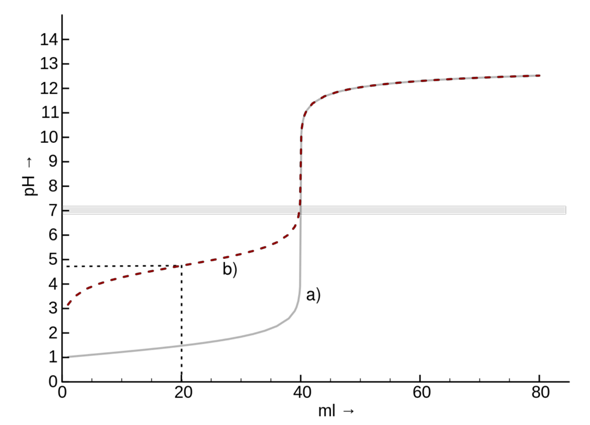

Die Indikator-Moleküle sagen Dir durch ihre Farbe den pH der Lösung, in der sie schwimmen. Wie sie das machen, ist vermutlich nicht die Frage, die Du stellen wolltest, und daher gehe ich nicht darauf ein.
Wenn Du z.B. eine Säure wie HCl oder H₂SO₄ oder CH₃COOH mit einer Base wie NaOH titrierst, dann ist die Probelösung sauer, und der zugesetzte Indikator zeigt also seine saure Farbe. Die Maßlösung ist dagegen alkalisch; würdest Du Indikator in die Maßlösung schütten, dann nähme dieser seine alkalische Farbe an.
Bei Zutropfen der Maßlösung zu Probelösung (die den Indikator enthält), tritt also Neutralisation ein, d.h. der Kolbeninhalt wird immer weniger sauer und immer mehr alkalisch, je mehr Maßlösung dazukommt. Irgendwann wird der pH erreich, an dem der Indikator seine Farbe wechselt, und dann ist die Titration zu Ende.
Gegen Ende der Titration kann es vorkommen, daß ein Tropfen der Maßlösung zwar nicht den pH des ganzen Kolbeninhaltes, aber zumindest von ein paar ml desselben soweit erhöhen kann, daß der Indikator umschlägt. In diesem Fall beobachtet man an er Eintropfstelle eine ausgedehnte Verfärbung die beim Umrühren oder Schütteln wieder verschwindet. Wenn Du so etwas siehst, dann weißt Du, daß das Ende der Titration nicht mehr fern ist, weil ein Tropfen Maßlösuung zwar nicht den ganzen Kolbeninhalt, aber durch schon einen merklichen Teil davon neutralisieren kann.