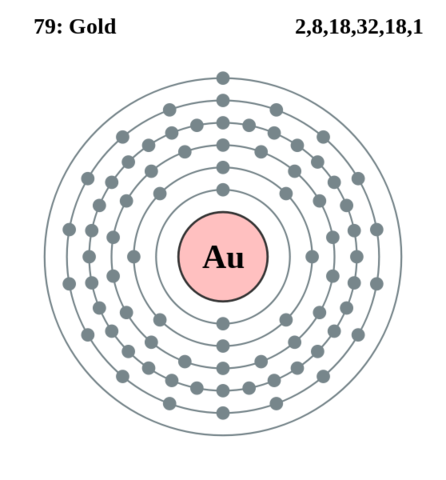
Mich verwirrt der Begriff Elektronenkonfiguration der bei Gold einerseits mit 2, 8,18, 32, 18 und 1 (Bild) andererseits mit [Xe] 4f145d106s1 angegeben ist?
Gibt es da im Hintergrund eine Verbindungserklärung zwischen diesen zwei Konfigurations-Angabe-Varianten?
2 Antworten

Guck dir mal die vollständige Elektronenkonfiguration an
[Xe] 4f14 5d10 6s1
Orbital Elektronen
1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s 2
4p 6
4d 10
4f 14
5s 2
5p 6
5d 10
5f 0
6s 1
6p 0
6d 0
Mit 2, 8, 18, 32, 18 und 1 werden die Elektronen jeder Schale angegeben.
auf Schale 1 (1s) passen also 2 e-
auf Schale 2 (2s + 2p) passen also 8 e-
auf Schale 3 (3s + 3p + 3d) passen also 18 e-
auf Schale 4 (4s + 4p + 4d + 4f) passen also 32 e-
auf Schale 5 (5s + 5p + 5d) passen 18 e-
auf Schale 6 (6s) passen 2 e-, ist aber nur 1 e- drauf.
Die Elektronenkonfiguration ist einfach nur ein genaueres Aufsplitten der Elektronenschalen in Orbitale. Denn Elektronen bewegen sich nicht im bohrschen Atommodell um den Atomkern sondern in sogenannten Elektronenwolken (Orbitalen).
Um die vollständige Elektronenkonfiguration abzukürzen schreibt man z. B. [Xe] welches die Elektronenkonfiguration von Xenon bedeutet + den angehängten Rest.


Also die 2,8,18,32,18,1 beschrieben die Elekteonen auf den Schalenbahnen im Bohr‘chen Atommodell, wie auf deinem Bildzu sehen.
Ein anderes Modell ist das Orbitalmodell, welches die Aufenthaltswarscheinlichkeit der Elektronen genauer beschreibt. Schau dir mal Bilder dazu an am besten. Ein s-Orbital ist z.b. kugelförmig um den Kern herum aufgebaut.
Elektronenkonfiguration bedeutet ja, wo denkt man, dass Elekteonen sich aufhalten. Bei Bohr eben einfach auf den Schalen. Im Orbitalmodell in dreidimensionalen Orbitalen verschiedener Formen. Ein Orbital kann immer zwei Elektronen enthalten, das heißt, dass bei den d-Orbitalen 10 Elektronen in 5 Orbitalen sein können.
Zusammenhang ist schon da, jedoch nicht weiter von Bedeutung würde ich mal behaupten.