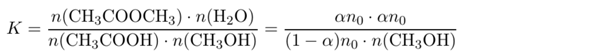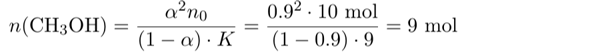Massenwirkungsgesetzt?
Welche Stoffmenge an Methanol muss eingesetzt werden, um 10 mol Essigsäure zu 90% zu verestern? Die Gleichgewichtskonstante beträgt 9
Was soll ich machen bei dieser Aufgabe wie fange ich an . Lösung und weg wäre super habe noch mehr Aufgabe von dieser Sorte( könnte die dann selber lösen)
1 Antwort

Die Reaktion lautet:
CH₃COOH + CH₃OH ⟶ CH₃COOCH₃ + H₂O
Da die Anzahl der Moleküle gleich bleibt, spielt das Volumen keine Rolle, und man kann das Massenwirkungsgesetz auch gleich in Stoffmengen statt wie üblich Konzentrationen formulieren. Außerdem schreiben wir n₀ für die eingesetzte Stoffmenge an Essigsäure (n₀=10 mol) und α für den umgesetzten Anteil davon (α=90%). Für jedes umgesetzte Molekül CH₃COOH entstehen je ein Ester- und Wassermolekül:
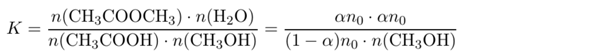
In diesem Ausdruck kennen wir alles bis auf n(CH₃OH), der Stoffmenge Methanol im Gleichgewicht. Also können wir die Gleichung umstellen und es ausrechnen:
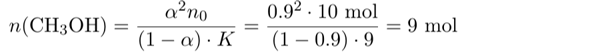
Es müssen also 9 mol Methanol im Gleichgewicht frei, also unverestert, vorliegen. Gleichzeitig haben wir 9 mol Ester im Kolben, deren Bildung weitere 9 mol Methanol verbrauchte. Also müssen wir insgesamt 18 mol Methanol zugeben.