Kann mir jemand den Verlauf der titrationskurve erklären?
Hallo, wir haben als Thema ,,Leitfähigkeitstitration‘‘
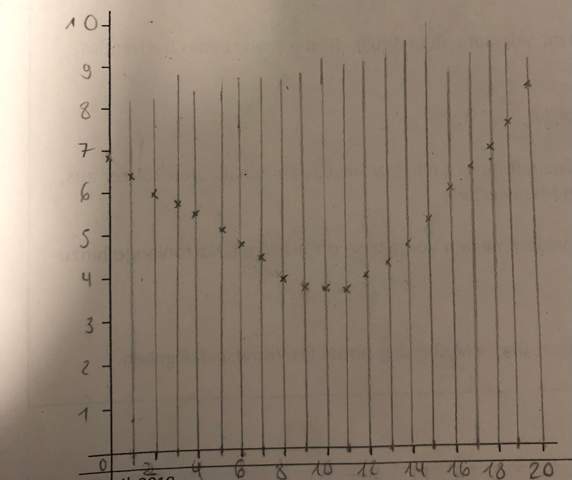
und wir haben Salzsäure mit NaOH titriert. Auf der x-Achse haben wir V(NaOH) in ml und y-Achse die Stromstärke in mA
Kann mir jemand bitte den Verlauf der Titrationskurve erklären?

Aufgabe 1

2 Antworten

Im ersten Teil der Titrationskurve (bis 10 ml) läuft die Neutralisation ab. Zuerst hast Du also HCl (= H₃O⁺ + Cl⁻), die leitet gut. Bei V=10 ml hast Du immer noch dieselbe Menge Cl⁻-Ionen in der Suppe, aber statt H₃O⁺ tummeln sich nun die Na⁺-Ionen. Vom Standpunkt der Leitfähigkeit ist das ein Verlust, denn H₃O⁺ ist viel beweglicher als Na⁺, leitet den Strom also viel besser. Deshalb nimmt die Leitfähigkeit in diesem Teil der Kurve ab und erreicht ein Minimum, wenn alle H₃O⁺ verbraucht und durch Na⁺ ersetzt sind.
Danach tritt keine chemische Reaktion mehr auf, aber das neu zugeschüttete NaOH bringt neue Ionen Na⁺ und OH⁻ in den Kolben, die die Leitfähigkeit wieder erhöhen. Besonders wichtig ist dabei das OH⁻, denn das ist auch sehr beweglich (wenn auch nicht so sehr wie H₃O⁺) und gibt daher einen kräftigen Beitrag zur Leitfähigkeit, es kann also wieder mehr Strom fließen.

Moin,
das ist doch nicht weiter schwer:
Am Anfang hast du eine salzsaure Lösung. Das heißt, dass in dieser wässrigen Lösung ausschließlich Oxoniumionen und Chloridanionen vorhanden sind, weil du ja Chlorwasserstoff (Hydrogenchlorid) in Wasser gelöst hast:
HCl(g) + H2O(l) ---> H3O+(aq) + Cl–(aq)
Da also viele Ionen in der salzsauren Lösung sind, hast du auch eine tolle elektrische Leitfähigkeit. Elektrischer Stromfluss ist ja nur mögliche, wenn es bewegliche elektrisch geladene Teilchen gibt. Das können Elektronen sein (wie in Metallen) oder Ionen (wie in Lösungen von Salzen oder Säuren).
Doch nun titrierst du eine Natriumhydroxidlösung (Natronlauge) hinzu. Dadurch kommt es mit jedem Tropfen Natronlauge in der salzsauren Lösung zu einer Neutralisationsreaktion. Die sieht so aus:
Na+(aq) + OH–(aq) + H3O+(aq) + Cl–(aq) ---> Na+(aq) + Cl–(aq) + H2O(l)
Der namensgebende Prozess dabei ist die Reaktion der Oxoniumionen mit den Hydroxidanionen, die sich zu neutralem Wasser vereinigen:
OH–(aq) + H3O+(aq) ---> H2O(l)
Damit „verschwinden” ständig bewegliche Ladungsträger aus den zusammengeführten Lösungen und werden zu neutralen Wassermolekülen. Die Wassermoleküle selbst sind jedoch aufgrund ihrer Neutralität nicht mehr in der Lage, elektrischen Strom zu transportieren. Daher fällt die elektrische Leitfähigkeit logischerweise.
Nach einer Zugabe von 11 mL NaOH hast du den Tiefpunkt der Leitfähigkeit erreicht. Hier ist die Stoffmengenkonzentration von Säure und Lauge gleich. Die Leitfähigkeit fällt natürlich nicht auf 0 (Null), weil du in der Lösung ja immer noch bewegliche Ladungsträger in Form von Natriumkationen und Chloridanionen hast.
Aber an dieser Stelle hast du praktisch fast keine zusätzlichen Oxoniumionen oder Hydroxidanionen mehr in der Lösung.
Wenn du nun aber über diesen Punkt hinaus titrierst, also wenn du weitere Natronlauge zu dieser Lösung gibst, dann steigt die Leitfähigkeit natürlich wieder, weil die neutrale Salzlösung jetzt ja alkalisch wird, wobei nun Hydroxidanionen (und weitere Natriumkationen) hinzu kommen, die nicht mehr neutralisiert werden können, da es keine sauren Oxoniumionen mehr gibt.
NaOH(aq) --[H2O]--> Na+(aq) + OH–(aq)
Da von da an die Konzentration von beweglichen Ladungsträgern wieder steigt, steigt auch die elektrische Leitfähigkeit der Lösung.
Logisch, oder?!
LG von der Waterkant