H2SO4 OH- Protolyse?
wird es am Ende zu : so4 2- + 2H20
oder zu: so4 2- + h3O +
?
2 Antworten

Meinst Du die Reaktion von H₂SO₄ mit H₂O oder OH¯?
Mit OH¯ ist es einfach: Die Schwefelsäure reagiert quantitativ, also fast vollständig mit OH¯; je nachdem, wie die Stoffmengenverhältnisse H₂SO₄:OH¯ sind, kommt HSO₄¯ heraus (wenn 1:1) oder SO₄²¯ (wenn 1:2). Wenn Du Schwefelsäure mit der 1½-fachen Menge NaOH regieren läßt, dann reagiert die Hälfte der Schwefelsäure, zu Sulfat, und die andere Hälfte bleibt bei HSO₄¯ stehen.
Mit Wasser ist es komplizierter, weil da die Konzentration eine Rolle spielt: Wenn eine wäßrige Schwefelsäure deutlich konzentrierter ist als 0.01 mol/l, dann reagiert sie vorwiegend zu Hydrogensulfat HSO₄¯, wenn sie deutlich verdünnter ist, dann vorwiegend zu SO₄²¯. Dazwischen gibt es einen Übergangsbereich; bei 0.01 mol/l sind es 59% HSO₄¯ und 41% SO₄²¯, bei 0.1 mol/l aber bereits 92% HSO₄¯. Bei 0.001 mol/l sind es immerhin bereits 84% SO₄²¯.
Hier siehst Du es graphisch:
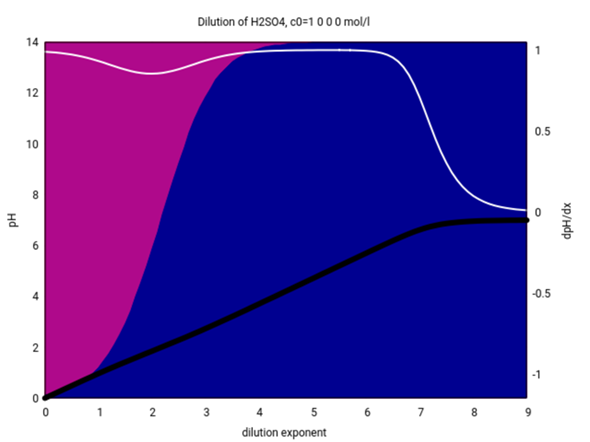
Die Abszisse gibt die Verdünnung logarithmisch an, also entsprich der Abzissenwert 2 einer Konzentration von c=10¯²=0.01 mol/l. Die schwarze Kurve zeigt den pH-Wert einer solchen Lösung (die weiße ist die erste Ableitung davon), und die Hintergrundfarbe zeigt, wieviel HSO₄¯ (violett) und SO₄²¯ (blau) in der Suppe herumschwimmt.

Zunächst: Achte bei chem. Symbolen auf die Groß- und Kleinschreibung!
Dann: Deine Frage ist eigentlich keine Frage... Was willst du sagen? Dass Schwefelsäure mit OH- reagiert?
Bei der Protolyse werden nacheinander zwei Protonen auf Wasser übertragen, also
H2SO4 + 2 H2O ---> 2 H3O+ + SO4 2-
Die Oxoniumionen kannst Du anschließend neutralisieren.
So wie in deinem Betreff geschrieben, würde ein OH- mit Schwefelsäure regieren:
H2SO4 + OH- ---> H2O + HSO4-

In einem basischen Milieu existiert kein HSO4-, da es sofort deprotoniert. Also die Antwort auf die – eher akademische – Frage: Solange OH- anwesend ist, wird jedes Proton erstmal dieses protonieren. Wenn das H+ allerdings vorher einem Wassermolekül über den Weg läuft, entsteht H3O+, das dann wiederum bei der ersten sich bietenden Gelegenheit sein Proton an OH- überträgt. Das Resultat ist dann dasselbe, nämlich H2O. Man kann für das Verhalten von Einzelteilchen keine verbindlichen Aussagen machen.
Jaja aber meine Frage war, wenn das zweite Proton vom HSO4- zum H2O Geht, wird es dann zu H30 oder Reagiert das HSO4- mit einem neuen OH-?