Fructose - Fischer und Haworth Projektion?
Halli Hallo, ich bin leider maßlos aufgeschmissen :( Morgen muss ich mein Chemie-Referat halten und ich beschäftige mich seit gestern damit, weil ich es nicht verstanden habe, habe ich meine Chemie-Lehrerin gefragt aber ich muss sagen, dass mir das nicht weiter geholfen hat.
Meine wesentlichen Fragen wären:
-
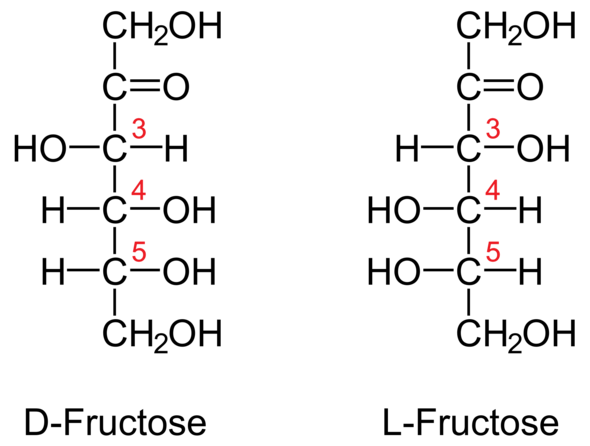
Was ist der Unterschied zwischen D-Fructose und L-Fructose?
-
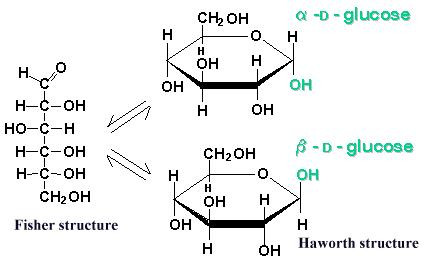
Gibt es eine leichte Möglichkeit von der Fischer zur Howarth Projektion zu kommen?
Chemie ist für mich jetzt nicht der größe klax, also ich wäre sehr erfreut wenn ihr Genies da draußen nicht mit der höchsten Form an Fachsprache antanzen würdet, haha.
Vielen lieben Dank im Vorraus :-)
3 Antworten

Zu 1.: Den Unterschied macht das letzte chirale Zentrum aus. Chirale Zentren sind Atome inerhalb eines Moleküls, an dem die Substituenten (also die "Anhängsel") frei drehbar sind. Das bedeutet, du kannst die Substituenten unterschiedlich anordnen, sie können verschiedene Stellungen zum Ausgangsatom annehmen.
Chirale Zentren sind oft Atome, die vier verschiedene Substituenten aufweisen. Nehmen wir uns Fructose als Beispiel. Stell dir ein Fructosemolekül in der Fischer-Projektion (siehe Bild) vor. Am obersten C-Atom hängen 2 H-Atome, es kann also kein chirales Zentrum sein. Das zweite C-Atom hat nur drei Substituenten. Aber das dritte, vierte und fünfte C-Atom ist jeweils ein chirales Zentrum.
Ob du nun D- oder L-Fructose vorliegen hast, siehst du-wie schon gesagt- am letzten chiralen Zentrum, also dem fünften C-Atom. An diesem musst du die OH-Gruppe betrachten, sie macht den Unterschied aus: Steht sie links, so hast du eine L-Glucose vorliegen. Steht sie rechts, musst du von einer D-Glucose ausgehen. Das ist eigentlich schon alles.
Merken kannst du dir das natürlich mit L= links. Oder du leitest dir das D von dem lateinischen (dextra= rechte Hand) ab, ich weiß ja nicht, ob die Latein hast...
Die Stellung der OH-Gruppe am letzten chiralen C-Atom hat Auswirkungen, beispielsweise wenn es um die Drehung von Lichtwellen geht. Wenn dich das interessiert, kannst du dich z.B. informieren, wie ein Polarimeter funktioniert...
Zu 2.: Nehmen wir uns einfach einmal D-Glucose zum Beispiel. Wir werden nun versuchen, die Fischerformel in deiner Vorstellung in eine Harworth zu verwandeln. Du kannst gerne mitzeichnen.
Drehe das Molekül um 90° im Uhrzeigersinn, sodass es quer liegt. Das erste C-Atom liegt nun ganz rechts. Nun wandert das fünfte C-Atom- das letzte chirale Zentrum- in die Richtung des ersten C-Atoms. Die Katze beißt sich quasi in den Schwanz. Die OH-Gruppe des fünften C-Atoms spaltet ihr H-Atom ab und schnappt sich stattdessen das erst C-Atom als Bindungspartner. Das abgespaltete H-Atom wird unter Auflösen der Doppelbindung an das frei stehende O-Atom gebunden.
Wenn du diese Schritte verstanden und dir vorgestellt hast, kannst du in jedem Fall immer eine Harworth-Projektion bilden.
Um das ganze zu beschleunigen, musst du wissen, dass das erste C-Atom in der Fischer-Projektion das rechts stehendste in der Harworth ist. Nun brauchst du noch eine wichtige Regel: Fischer links -> oben Harworth. Das bezieht sich erneut auf die OH-Gruppen. OH-Gruppen, die bei Fischer links stehen, müssen bei Harworth nach oben ausgerichtet sein.
Bei Harworth gibt es außerdem noch eine Unterscheidung in Alpha und Beta. Dies betrifft die OH-Gruppe am ersten, dem sogenannten anomeren C-Atom, also dem ganz rechts stehenden. Zeigt die OH-Gruppe nach oben, so hast du eine Beta-Konstruktion. Eselsbrücke: "Hochbett"
Ich hoffe, das war nicht zu viel Fachsprache und ich konnte helfen. Ich bin nur leider immer so hyperausführlich, dass die Antworten sehr spät erst eintreffen. Ich kann dir übrigens wirklich einen YouTube-Kanal empfehlen, der bei vielen solcher Fragen weiterhilft: "The SimpleClub"- die helfen auch in Mathe, Bio und Physik. Viel Glück bei deiner Präsentation!!!

https://de.wikipedia.org/wiki/Fructose
1) In der Fischerprojektion liegt am 5ten C-Atom von oben=vorletztes die OH-Gruppe nach rechts=dexter=D-Fructose, bei der l-Form=laevus nach links.
2) Es gibt eine mittelschwere Möglichkeit (Kontrolle im Link):
man stellt sich die Mitte des Zuckers nach vorne, oberen und unteren Teil nach hinten gebogen vor, verbindet über die O-Brücke (war vorher das OH Nummer 5, der H hängte sich an den =O an C-Nummer2 und machte ein neues OH, das letzte CH2OH mußte dazu nach links gedreht werden) und kippt das Ganze nach rechts (also im Uhrzeiger) in eine perspektivische Ebene (O-Brücke kommt nach oben=hinten zu liegen)
3) Besser: man bastelt sich ein Stabmodell und murkst so lange damit, bis man es im Schlaf kann.

Zu 1:
Wenn Du die D-Glucose in der Fischer-Projektion hast, dann erhältst Du die L-Form, wenn Du an den asymmetrischen C-Atomen (Nr. 2, 3, 4 und 5) die OH-Gruppen und die H-Atome vertauschst. Also nicht, wie oft fälschlicherweise dargestellt, nur am C-Atom Nr. 5.
Von den Eigenschaften her ist die D-Glucose rechtsdrehend (+) und die L-Glucose linksdrehend (-). Gemeint ist, dass die Schwingungsebene des polarisierten Lichts nach rechts bzw. links gedreht wird.
Die L-Glucose kann man nur synthetisch herstellen.
Zu 2:
Hier ist die Antwort komplizierter, denn in der Haworth-Projektion wird das C-Atom Nr. 1 auch asymmetrisch. Es ist dann nicht egal, ob dort die OH-Gruppe "oben" (= beta-Form) oder "unten" (= alpha-Form) steht.
Ich forme mir die Fischer-Projektion zu einem Sechseck (pyranoide Form), wobei das C-Atom Nr. 1 rechts liegen soll. Das O-Atom der Halbacetalbildung ist das Eck Nr. 6.
Rechne aber bei Deinem Referat mit folgender Frage: Warum gibt es überhaupt zwei Arten der Projektionsformeln? Reicht nicht auch eine?