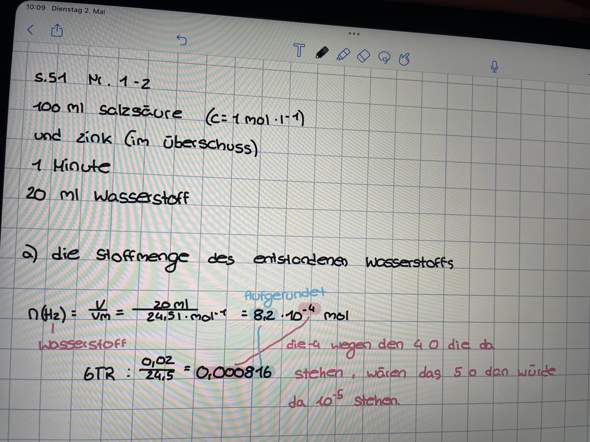
Die stoffmenge des entstehenden Wasserstoffs?
ich hab die Lösungen ehrlich gesagt abgeschrieben und versucht die Aufgaben mir mit den Lösungen erklären zu können was ich aber nicht verstehe ist warum die 24,5 unten im bruch steht woher kommt die zahl kann mir wer dabei helfen?
2 Antworten

1 mol ideales Gas hat bei SATP (dass sind 298.15K (25°C) und eine Atmosphäre Druck, also normaler Umgebungsdruck) ein Volumen von ... 24,8L Ich weiß jetzt auch nicht, warum da 24,5 statt 24,8 stehen. aber jo, is halt so. kannst auch mittels der idelen Gasgleichung p*V=n*R*T versuchen selber drauf zu kommen. Tipp: immer in SI Einheiten arbeiten und im Zweifelsfall später umrechen, so kommt garantiert kein grober Unfug bei raus.


Die Zahl 24,5 gibt das Volumen von n(H2) = 1 mol bei bestimmten Bedingungen (Temperatur, Druck) an. Es ist V0 = 24,5 L/mol. V0 wurde vom Aufgabensteller hier vorgegeben.
Die errechnete Stoffmenge n(H2) = 8,2 · 10-4 mol nimmt bei den vorgegebenen Bedingungen V(H2) = n · V0 = 8,2 · 10-4 mol · 24,5 L/mol = 0,02 L ein.
Hinweis: In der letzten Zeile Deiner Berechnungen müssen unbedingt die Einheiten mitgeschrieben werden!