Chemie?
Hi, kann mir jemand erklären, was ich wo der 1. Aufgabe machen soll und wie ich diese Werte herausfinde? und was genau fehlt denn noch bei den Reaktionsgleichungen? Thema ist Mesomerieenergie
1 Antwort

Das ist Dir ja schon einmal ganz gut erklärt worden: https://www.gutefrage.net/frage/chemie-mesomerieenergie#answer-492299653
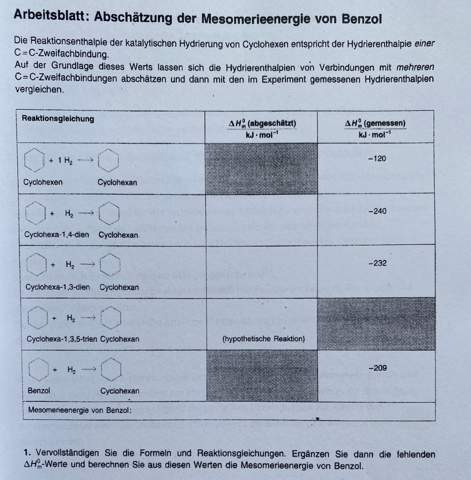
Zuerst einmal zeichnest Du die Doppelbindungen so in die Sechsringe ein, wie sie eben gehören — eine fürs Cyclohexen zwei fŭr die beiden Cyclohexadiene, drei fürs „Cyclohexatrien“ (das es ja nicht gibt) und einen Ring fürs Benzol, der die delokalisierten Doppelbindungen symbolisiert. Außerdem mußt Du die stöchiometrischen Koeffizienten richtigstellen, weil die Reaktionen unterschiedlich viel H₂ verbrauchen (nämlich eines pro Doppelbindung).
Dann überlegst Du Dir: Eine Doppelbindung zu hydrieren bringt 120 kJ/mol (sieht man am Beispiel Cyclohexen). Bei zweien würde man also 240 kJ/mol erwarten; das trifft beim 1,4-Cyclohexadien auch wirklich zu, aber das 1,3-Cyclohexadien weicht ein kleines Stück ab, da liefert die Hydrierung nämlich nur 232 kJ/mol, also 8 kJ/mol weniger als erwartet. Das 1,3-Isomere ist also um 8 kJ/mol stabiler als das 1,4-Isomere, oder nochmals anders gesagt, die Konjugation im 1,3-Cyclohexadien schenkt dem Molekül eine Extrastabilisierung von 8 kJ/mol.
Was folgt daraus fürs Cyclohexatrien?
- Wenn Du ein Fan von „Resultat = π ⋅ tan(Daumen)“ bist, dann ignorierst Du die Komplikation bim 1,3-Cyclohexadien und erwartest fürs Cyclohexatrien einfach dreimal die Hydrierungswärme des Cyclohexens, also 360 kJ/mol. Real sind es nur 209 kJ/mol. Die 151 kJ/mol Differenz sind dann die Stabilisierung durch Elektronendelokalisierung. Oder anders gesagt: Was auch immer das Benzolmolekül so speziell macht und wie auch immer sich die Elektronen darin herumgurken, das Molekül gewinnt dadurch 151 kJ/mol an Stabilität.
- Wenn Du lieber mit komplizierteren Korrekturinkrementen herumjonglierst: Die Konjugation (also benachbarte Lage) der Doppelbindungen im 1,3-Cyclohexadien brachte 8 kJ/mol Extrastabilisierung. Im Cyclohexatrien würden drei solche Nachbarschaftsbeziehungen existieren, also könnte man eine Extrastabilisierung von 24 kJ/mol erwarten, und damit eine Hydrierwärme von 360−24=336 kJ/mol. Da die Hydrierwärme von Benzol aber nur 209 kJ/mol beträgt, liegt eine Extraextrastabilisierung von 127 kJ/mol für das Benzolmolekül vor.
- Keine dieser berechneten Stabilisierungen entspricht einer beobachtbaren Größe; mit anderen Beobachtungen kann man auch andere Wege finden, eine solche “Extrastabilisierung von Benzol“ zu defiieren und zu berechen. Die Zahlen sind immer anders, aber akzeptabel ähnlich (nämlich mehr als 120 kJ/mol, die Hydrierungsenergie einer einzelnen Doppelbindung). Man kann also sagen, daß im Benzolmolekül irgendetwas Ungewöhnliches vorgeht (die sogenannte „Mesomerie“), das dieses Molekül grob 130 bis 150 kJ/mol stabiler macht als man erwarten würde.