Chemie: Elektronegativität und Dipole?
Hallo, kann mir jemamd dieses Bild erklären und was Dipole sind? Es hat mit Elektronegativität zu tun.
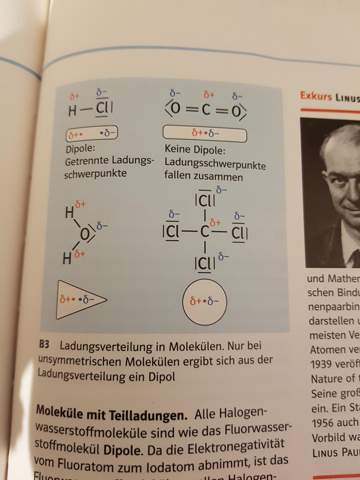
2 Antworten

Hey
Du weißt ja schon, dass Erlektronegativität angibt (in einfachen Worten), wie stark ein Element an den Bindungselektronen zieht. Zieht es stärker daran, sorgt die zusätzliche negative Ladung der angezogenen e, dass es es delta minus, also leicht negativ geladen ist. Sobald das auftritt, nennt man es Dipol, denn es hat ja zwei unterschiedliche Ladungsschwerpunkte (die eine Seite leicht negativ=negativer Pol ;die andere leicht positiv=positiver Pol => zwei Pole [Dipol heißt übersetzt Zweipol])
Wenn jetzt aber an den gegenüberliegenden Seiten zwei Elemente an dem mittleren gelich stark anziehen dann hätten die beiden an der genau gegnüberliegenden Stelle den selben Ladungsschwerpunkt und dadurch hebt der sich auf. Daraus folgt, dass das Atom keinen Ladungschwerpukt mehr hat, also kein Dipol ist.

Sauerstoff hat beispielsweise die grössere Elektronegativität als Wasserstoff. Weil das Wassermolekül gewinkelt ist, hat es dadurch eine leicht positive und eine leicht negative Seite (Dipol). Diese Moleküle sind polar, somit ziehen sie sich gegenseitig an.
Beim Kohlenstoffdioxid besteht zwischen den Atomen zwar auch eine unterschiedliche Elektronegativität, aber weil das Molekül symmetrisch ist, ist es nach außen neutral ohne positive und negative Seite, d.h. es ist apolar (kein Dipol). Sie ziehen sich gegenseitig nicht an.
Beachte dazu auf dem Bild Dipole und keine Dipole.