Bindungsart Chemie NO?
Bestimme die Bindungsart des Stoffes NO.
könnte mir jemand helfen Danke❤️
3 Antworten

Moin,
Stickstoffmonoxid besteht aus einem Stickstoff- und einem Sauerstoffatom, die beide über eine doppelte Elektronenpaarbindung (Atombindung; N=O-Doppelbindung) miteinander verbunden sind.
Die Doppelbindung ist nahezu unpolar, EN(N): 3,04, EN(O): 3,44 (aktuelle Pauling-Skala), bis minimal polar, EN(N): 3,07, EN(O): 3,50 (aktuelle Alred-Rochow-Skala).
Das MO-Schema zeigt, dass das Molekül ein (relativ stabiles) Radikal ist, weil das Stickstoffatom ein ungepaartes Elektron behält.
Eine Lewis-Schreibweise wäre:
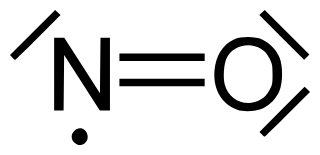
LG von der Waterkant
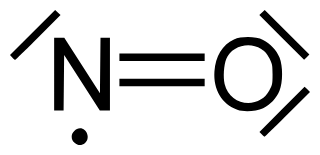

Der Sauerstoff ist mit dem Stickstoff über eine Doppelbindung kovalent gebunden. Am Sauerstoff verbleiben wie üblich zwei freie Elektronenpaare. Am Stickstoff verbleibt ein freies Elektronenpaar und ein ungepaartes Elektron. Damit handelt es sich beim N=O um ein Radikal. Das Molekül ist infolge der unterschiedlichen Elektronegativitäten von O und N leicht polar.

Es ist eine unpolare Elektronenpaarbindung.
Elektronegativität N: 3,04
Elektronegativität O: 3,44
EN=0,4
Ist EN > 0,5 -> dann unpolar.
https://www.schule-studium.de/Chemie/Chemieunterricht/Bindungstyp-ermitteln-nach-EN-Wert.html