Elektrolyse Erklärung 😭?
Hallo, kann mir jemand zu Elektrolyse diese Abbildung in einfachen Worten erläutern
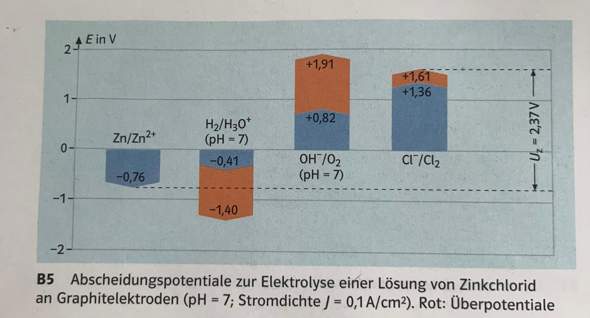
1 Antwort

Konzentrieren wir uns erstmal auf die blauen Bereiche:
Das sind die normalen elektrochemischen potentiale der Teilreaktionen. Wenn du eine Elektrolyse in wässriger Lösung durchführst, können an jeder Elektrode zwei Reaktionen auftreten. Erstens die eines Ions des gelösten Stoffs (hier also Zink/Chlor aus Zinkchlorid) oder die vom Wasser. Bei letzterer würde dann H2 und O2 entstehen, wie man bei Balken 2 und 3 sieht.
Anhand dieser (Normal-)Potentiale kann man bestimmen, welche Reaktion abläuft. Es ist immer die, die die geringste Spannung benötigt. Bei der Elektrolyse von Zinkchlorid kommst du auf 2,12 V, bei der von Wasser auf 1,23 V. Man sollte also meinen, dass Wasser bevorzugt reagiert. Baut man nun aber einen Versuch auf und schaltet den Strom an, stellt man fest, dass doch das Zinkchlorid elektrolysiert wird. Warum ist das jetzt so?
Das verraten uns die roten Bereiche. Wie du ja wissen solltest, braucht man bei einer Elektrolyse immer etwas mehr Spannung als bei der entsprechenden galvanischen Zelle abgegeben wird. Das nennt man Zersetzungsspannung. Wie hoch diese Zersetzungsspannung jetzt ausfällt, hängt von den Stoffen ab, die bei den Reaktionen entstehen (das ist noch etwas komplizierter, aber soweit will ich hier jetzt nicht gehen). Den Unterschied zwischen den normalen Potentialen und der eigentlichen Zersetzungsspannung nennt man Überspannung (das sind die roten Bereiche)
Wie du siehst, sind die Überspannungen bei Chlor und Zink sehr klein (bei Zink ist nicht mal eine vorhanden). Bei H2 und O2 sind die aber extrem groß. Das führt dazu, dass sich die benötigten Spannungen ändern. Bei Zinkchlorid kommst du damit auf die angegebenen 2,37 V, bei Wasser auf 3,31 V (Wasser hatte vorhin noch 1,23 V). Das heißt, jetzt hat die Elektrolyse von Zinkchlorid die niedrigere Spannung und läuft bevorzugt ab, so wie man es eben auch im Experiment beobachtet.