chemie :bilde mit der oktettregel die ionen von Lithium?hilfe?
im anhang befindet sich die gleichung nochmal als bild meine frage:ist die gleichung so richtig weil lithium möchte ja ein edelgas werden und muss somit ein elektron abgeben des wegen verstehe ich nicht warum geschrieben wird Li plus ein elektron abwohl doch eins weg muss also doch eigentlich minus? das eine plus was weiter oben steht steht ja für positiv geladen also das erste plus das habe ich verstanden aber mit dem anderen hätte ich statt plus minus geschrieben bitte um hilfe
danke schonmal
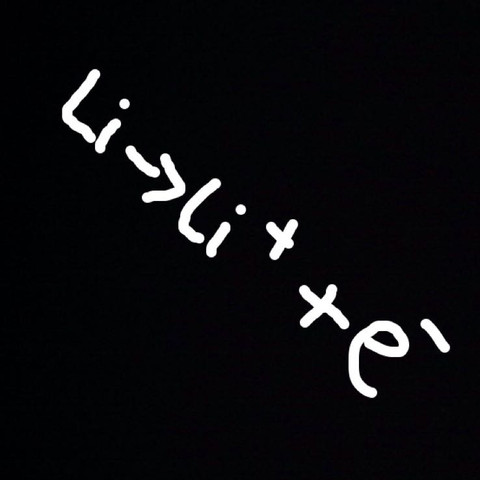
3 Antworten

Moin,
also zunächst einmal etwas zu deiner Formulierung: "Lithiumatome möchten ein Edelgas werden". Das kannst du so nicht schreiben, wirklich nicht! Dabei meine ich weniger, dass Lithiumatome nach unserem Verständnis nichts "möchten" können, weil dazu im Grunde ein Ich-Bewusstsein oder doch zumindest ein vergleichsfähiges Bewusstsein nötig wäre nach dem Motto: Im Moment bin ich ein Metallatom, ich wäre aber lieber ein Edelgas!
Wie gesagt, das meine ich weniger. Was schlimmer an dieser Formulierung ist, ist die falsche Vorstellung, dass ein Atom durch Veränderungen seiner Elektronensituation ein anderes Atom werden könne. Das ist nämlich nicht so. Was du meinst, ist: Die Anzahl und Anordnung der Elektronen in Edlegasatomen (Edelgaskonfiguration) ist von der Energie her gesehen so günstig, dass jede Veränderung daran einen energetischen Nachteil bedeuten würde. Die Atome von den anderen Elementen haben keine solch günstige Edelgaskonfiguration. Deshalb reagieren sie munter miteinander, damit sie diese Edelgaskonfiguration erhalten können.
Der Unterschied in diesen Aussagen ist, dass die Atome kein Edelgas werden, sondern lediglich deren Elektronenkonfiguration "anstreben".
Doch nun zu deinem Problem...
Auch hier eine Erläuterung vorab: Es gibt (im Grunde) zwei verschiedene Edelgaskonfigurationen, nämlich die von Helium und die vom Rest der Edelgase. Heliumatome haben zwei Valenzelektronen (Außenelektronen) in ihrer Atomhülle. Offenbar ist das eine günstige Variante (weil Helium sonst nicht zu den Edelgasen gerechnet würde). Die anderen haben acht Valenzelektronen (Oktettregel), was offenbar die andere günstige Variante darstellt. Dass Helium mit nur zwei Valenzelektronen bereits "glücklich" ist (zu den Edelgasen gehört), liegt daran, dass in das innerste Hauptenergieniveau (HEN) nur zwei Elektronen passen. In die anderen Hauptenergieniveaus passen (stark vereinfacht gesagt) acht Valenzelektronen...
Lithiumatome haben nun drei Elektronen in ihrer Hülle, nämlich zwei im innersten HEN und ein weiteres in ihrem äußeren. Um die angestrebte Edelgaskonfiguration zu erhalten, müssten Lithiumatome also entweder ein Elektron loswerden oder sieben aufnehmen. Im ersten Falle hätte das Lithiumteilchen dann die Edelgaskonfiguration von Helium, im anderen Falle die von Neon. Nun sind aber die Abgabe oder die Aufnahme von Elektronen mit einem Energieaufwand verbunden. Beide benötigen etwa gleich viel Energie. Unter diesen Umständen ist es energetisch viiiiiel einfacher ein Elektron abzugeben als sieben aufzunehmen! Darum neigen Lithiumatome in Reaktionen dazu, das eine Valenzelektron abzugeben.
Wenn ein Atom ein Elektron abgibt, wird es zu einem positiv geladene Kation. Bleiben wir mal beim Lithiumatom. Es hat nicht nur drei negativ geladene Elektronen in seiner Atomhülle, sondern auch drei positiv geladene Protonen in seinem Kern. Weil es also von positiven und negativen Ladungsträgern gleich viele hat, ist es als Atom ungeladen (die Wirkungen der positiven und negativen Ladungsträgern heben sich nämlich gerade gegenseitig auf). Wenn nun aber ein Lithiumatom sein einzelnes Valenzelektron aus der Hülle entfernt, wird es zu einem Positiv geladenen Kation, weil sein Kern von dieser Elektronenabgabe völlig unbeeinflusst bleibt. Mit anderen Worten, das Lithiumatom hat nach der Abgabe eines Elektrons nur noch zwei Elektronen in seiner Hülle, aber immer noch drei Protonen im Kern. Weil es also einfach positiv geladen wird, bleibt es auch kein ungeladenes Atom mehr, sondern wird zu einem geladenen Kation.
Und nun (endlich) zu deiner Frage. Wenn ein Lithiumatom ein Elektron abgibt (um die Edelgaskonfiguration von Helium zu erlangen), dann hast du ein Lithium-Kation und ein Elektron (das ein Reaktionspartner aufnehmen muss). Genau das drückst du mit folgender Gleichung aus:
Li ---> Li^+ + e^–
Ein ungeladenes Lithiumatom wird zu einem positiv geladenen Lithium-Kation und einem negativ geladenen Elektron (weil es dieses Elektron abgibt).
Rein theoretisch könntest du auch auf folgendes kommen:
Li – e^– ---> Li^+
Ein Lithiumatom, dem ein negativ geladenes Elektron abgezogen wird, wird zu einem positiv geladenen Lithium-Kation.
Aber bei Reaktionsgleichungen muss nicht nur die Stoffbilanz ausgeglichen sein (gleich viele Teilchen jedes Elementsymbols auf beiden Seiten des Reaktionspfeils da sein), sondern es muss auch die Ladungsbilanz ausgeglichen sein. Und da wird es bei der zweiten Darstellung insofern problematisch, weil du schon darauf kommen musst, dass "– e^–" im Grunde eine doppelte Negierung ist (minus mal minus ergibt plus). Die Sache wird unübersichtlicher bzw. komplizierter. Darum hat sich durchgesetzt, dass man in Reaktionsgleichungen nicht subtrahiert, sondern stets alles in Form von Summen aufschreibt. Und deshalb schreibt man das abgegebene Elektron auf die Seite (additiv dazu), wo auch das Kation steht. Deshalb ist also
Li ---> Li^+ + e^–
richtig, denn hier stimmt beides, die Teilchenanzahl (auf beiden Seiten ist ein Li-Symbol) und die Ladungsbilanz: links steht keine Ladung, rechts eine Plus- und eine Minusladung (was sich zusammen zu Null Ladung addiert)...
Alles klar?!
LG von der Waterkant.

Da steht + e^- weil Lithium ein Elektron haben will. Jedes Element hat das Bestreben seine Außenschale mit 8 Valenzelektronen zu füllen.(Ausnahme-> Helium und Wasserstoff) Wozu sollte Lithium dann ein Elektron abgeben wollen, wenn es Elektronen brauch? XDD

Wenn es ein Elektron abgibt kann es kein Edelgas werden. Lithium hat 3 Schalen auf der 1. sind es 2 Elektronen auf der 3. nur 1, wenn es dieses abgibt sind aber 0 Elektronen auf der dritten Schale vorhanden? Oktettregel sagt ganz klar -> 8 Außenelektronen, werden Elektronen abgegeben klappt das nicht. Bestes Beispiel ist Chlor, dieses Element braucht nur noch 1 Elektron zur Edelgaskonfiguration, würde es eines abgeben, wäre das nicht möglich. Also + e^-

Da steht + e^- weil Lithium ein Elektron haben will.
Unsinn. Lithium gibt ein Elektron ab, wenn das Atom zum Ion wird.
Jedes Element hat das Bestreben seine Außenschale mit 8 Valenzelektronen zu füllen.(Ausnahme-> Helium und Wasserstoff)
Schon wieder Unsinn. Auf dem Niveau der Chemie sind auch Lithium,Beryllium, Bor und teilweise Kohlenstoff solche Ausnahmen.
Wozu sollte Lithium dann ein Elektron abgeben wollen,
Um zum Ion zu werden
wenn es Elektronen brauch?
Wozu soll es denn welche "brauchen"?

Klar kann es auch ein Ion durch das Abgeben von Elektronen werden (Kation) aber wenn die Oktettregel gilt, müsste Lithium doch zum Anion durch ELektronenaufnahme werden oder nicht?

aber wenn die Oktettregel gilt,
Die gilt aber nicht für Lithium
müsste Lithium doch zum Anion durch ELektronenaufnahme werden
7fach negativ geladen.
oder nicht?
Weiß ich nicht, mir ist noch kein mehr als 4fach geladenes simples Anion über den Weg gelaufen. Bei Kationen ist das kein Problem, denen kann man alle Elektronen rauben, sa daß der nackte Kern übrigbleibt. Das Verfahren nennt sich Stripping und ist gängig in der Physik.

Lithium gibts ein elektron ab aber ich schreibe trotzdem + ein elektron

Wenn das tatsächlich so ist, warum? Wäre es nicht sinniger Elektronen aufzunehmen? Ein CHemiker hier?

EDIT: Ich revidiere. Habe an einer Kochsalzlösung gedacht. Metall-Atome = Kationen -> Nichtmetalle = Anionen :D so kann man sich das auch merken.

Das Lithiumion hat die gleiche Elektronenkonfiguration wie Helium, daher tritt es, wie alle anderen Alkalimetalle, als Ion in der Chemie einfach positiv geladen auf. Merk dir statt Oktettregel besser Edelgasregel.
aber es will doch zu einem edelgas werden(...) also muss es eins abgeben aber es wird trotzdem plus geschrieben aber warum