Redox-Gleichung
Hi, ich habe heute in meinem Chemie-Heft eine Redox-Gleichung gefunden (siehe Bild), die ich nicht mehr so ganz nachvollziehen kann.
- Wie kommt man im ersten Schritt auf die 3e- (bei Oxidation) bzw. die 4e- (bei Reduktion)?
- Wie kommt man im letzten Schritt von "4Al^3+ + 6O^2-" auf die endgültige Lösung?
Wäre nett, wenn mir das jemand erklären könnte. :-)
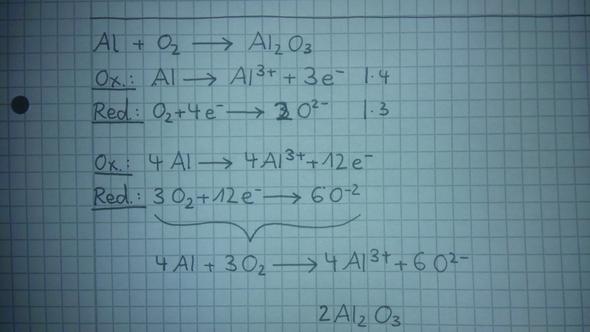
2 Antworten

Also Al wird ja zu Al^3+ , das heißt Aluminium ist dreifach positiv geladen, weil 3 e- abgegeben wurden. Deshalb ist es eine Oxidation, weil Elektronen abgegeben werden. O2 wird zu 2O^2- . Elektronen werden aufgenommen und damit findet eine Reduktion statt. Die Ox. zahl von O2 ist 0. Pro Sauerstoff werden quasi 2 e- aufgenommen. Dann muss ja die Gleichung noch ausgeglichen werden, deshalb mal 2. Deswegen 2O^2- . Dann hat man ja bei der Ox. 3e- stehen. Und bei der Red. 4e- . Dann muss man das auch noch so ausgleichen, dass auf beiden Seiten gleich viele Elektronen stehen, damit man diese wegstreichen kann. dann muss man das eben so multiplizieren, damit man die e- rausstreichen kann und multipliziert dabei eben die Zahl zu jedem Teil der Reaktion. Dann wenn man die e- rauskürzen kann, dann schreibt man einfach die Bestandteile der Ox und Red einfach nochmal nieder und hat die Gesamtgleichung bzw. Redoxreaktion

Al2O3
O hat die Oxidationszahl -2 (per Definition), also hat Al die OZ +3.
Deshalb gibt Al bei der Oxidation auch 3e- ab. Außerdem nimmt O2 4e- auf zur OZ 2-.
Aber O^(2-) Ionen kommen in der Realität nicht vor, deshalb vermeidet man sie auf dem Papier.
Besser wäre:
Ox: Al -> Al^(3+) + 3e^(-) | *2
Red: 2Al^(3+) + 3/2 O2 + 6e- -> Al2O3
2Al + 3/2 O2 -> Al2O3

Nein! Auf dem Bild ist alles perfekt dargestellt und Kanika17 hat es korrekt beschrieben.