Lewis-/valenzstrich Formel Nitrat-Ion?
Hallo nochmal:)
Ich dachte eigentlich ich hätte mit der Lewis Formel alles verstanden, nun bin ich beim Zeichen vom Nitrat Ion (NO3-) angelangt. Im Foto ist Nr. 1 die richtige Lösung, Nr. 2 wäre so wie ich es gemalt hätte.. Nun verstehe ich die Lösung nicht.. Den dort hat N ja auch nur 4 Elektronen obwohl es doch 5 hat? es ist somit dann positiv geladen.. das gesamte Ion ist zwar immer noch ein Anion, durch die beiden negativen Ladungen von jeweils 1 O, aber wäre meine Lösung da nicht auch korrekt? bzw ich verstehe mal wieder nicht was bei mir falsch ist:/
Vielen Dank schonmal im Voraus:)
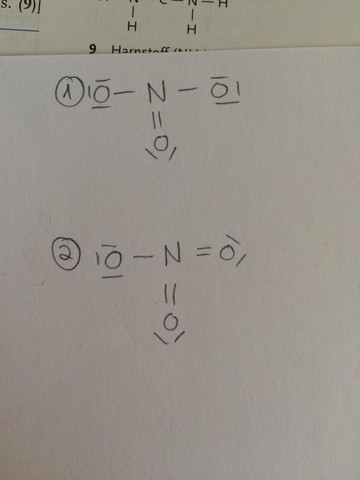
3 Antworten

Erstens: zeichne die Ladungen auch immer dazu (bei 1) und zweitens: du kannst bei Stickstoff nicht das Oktett überschreiten. Schwefel hingegen ist in der dritten Periode, da kannst du durchaus Oktettüberschreitungen machen (wenn der Aufgabensteller es nicht explizit untersagt).
Bei Elementen der zweiten Periode geht das nicht einfach so.

Also, Deine Lösung geht nicht. Denn sie verletzt die Oktettregel, und das darf man beim Sticki nicht (bei der analogen Phosphorverbindung wäre das möglich, weil Phosphor in der dritten Periode steht, und die dürfen solche Schweinereien machen, allerdings sieht Phosphat trotzdem anders aus).
Also ist die unsymmetrische Lösung mit einer N=O-Doppelbindung und zwei N–O-Einfachbindungen die richtige. Das wirft ein zwei Fragen auf.
- Sind die Bindungen unterschiedlich lang (2 lang und eine kurz)? Nein, sind sie nicht. Das Molekül ist wie ein gleichseitiges Dreieck gebaut, Stichwort Mesomerie (eine „Überlagerung“ von drei verschiedenen Lewis-Strukturen, wobei die Doppelbindung jeweils zu einem anderen Sauerstoff geht)
- Wie sieht das mit den Ladungen aus? Am Stickstoff haben wir eine Formalladung von +1, und an den beiden einfach gebundenen Sauerstoffen jeweils −1 (die Zahlen kriegt man, wenn man die Außenelektronen mit der Gruppennummer vergleicht, wobei Bindungen einfach und lone pairs doppelt zählen). Macht insgesamt −1, also die korrekte Ionenladung von NO₃²⁻. Paßt.

Du verletzt die Oktettregel

Die Elemente der dritten Periode haben noch die 3-d-Orbitale, die regulär bei den Übergangsmetallen vom Scandium bis zum Kupfer gefüllt werden.
Ob diese Orbitale bei Phosphaten, Sulfaten und Co. tatsächlich benutzt werden, darüber gibt es verschiedene Meinungen.
Ich hab es so gelernt, neueste Berechnungen (die auch schon Jahrzehnte zurückliegen) sprechen dagegen.
Ich kann die Berechnungen nicht nachvollziehen, habe aber eine gewisse Skepsis. Die oktaedtische Koordination im SF₆ lässt sich sowohl mit Doppelkeulenbindungen der p-Otbitale als auch mit der klassischen d²sp³-Hybridisierung erklären.
Und wozu soll ich beim Sulat, wenn ich schon eine Oktettaufweitung ablehne, nicht eine sp³-Hybridisierung annehmen, sondern wesentlich komplizierteres Zeug? Nach meiner Erinnerung auch Doppelkeulen, aber die hybridisieren.
Ich weiß, das geht über deinen Horizont, und das geht auch mehr an die Mitleser und Mitexperten.
Zwischen S und Sc liegen nur 4 Ordnungszahlen. Und dass die OZ die Rangfolge der Orbitale beeinlusst, ist ein alter Hut.
Ein Perchlorat mit einem formal +3 geladenem Chlor erscheint mir jedenfalls nicht recht "stimmig".
Um zu dir, Rebecca, zurückzukommen, das Zauberwort ist "Oktettaufweitung". Ob der Zauber noch gilt, weiß ich nicht sicher.

Ja, das habe ich mich auch oft gefragt. Anscheinend kann man die Oktettregel verletzen, aber nur in bestimmten Fällen... Aber für die Schulchemie solltest du dir merken, dass die Oktettregel nicht verletzt werden darf ;)

Richtig, wenn, dann ab der dritte Periode. Und genau, in der Schule lieber gar nicht ;)

Nur leider macht Wikipedia das permanent.
Und da ich es nicht entscheiden kann, bleibt es so.
Das habe ich auch erst gedacht, aber zb. beim Sulfat ion wird die Oktettregel auch verletzt und es ist trotzdem richtig. Deswegen dachte ich, das würde hier vielleicht auch gehen?
Dann wäre meine nächste Frage auch schon, wieso man beim Sulfat Ion die Oktettregel verletzten darf? Ich bin verwirrt:D