HNO2 - Ist dieser Molekülaufbau möglich?
Hallo zusammen,
hier ist mal wieder eine Chemie-Frage. In einer Übungsaufgabe wurde ich nach allen sinnvollen Valenzstrichformeln für verschiedene Verbindungen gefragt. Eine Verbindung ist HNO2.
Ich habe überlegt und bin auf zwei verschiedene mögliche Lösugnen gekommen. Einmal das bekannte Molekül für die salpetrige Säure und dann noch auf dieses (siehe Bild).
Ist das von mir gezeichnete Molekül nicht möglich bzw. sinnvoll? Im Internet habe ich diese Form nicht gefunden.
Ich würde mich sehr über Antworten freuen. Und falls meine Lösung falsch ist bitte erklärt mir auch, warum das Molekül so nicht möglich ist.
Viele Grüße!
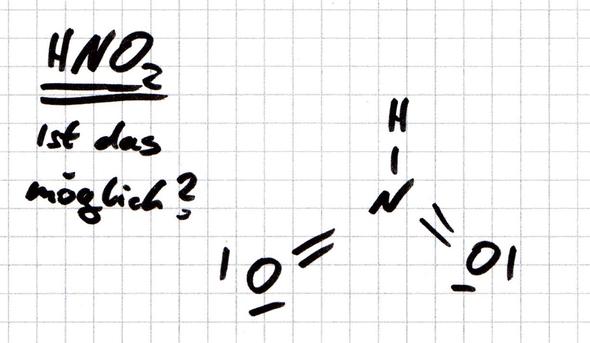
3 Antworten

Ich kann dir jetzt keine volle wissenschaftliche Erklärung liefern, aber in Anbetracht der Strukturformel von der salpetrigen Säure denke ich, dass deine Struktur extrem instabil ist.
Stickstoff befindet sich in einer sehr ungünstigen Situation, die er stehts dazu bestrebt ist aufzugeben. Er teilt 5 Elektronen und nicht 3, wobei 3 deutlich energiegünstiger wäre. Das Wasserstoff bildet einen lokalen Pluspol und daneben liegt Sauerstoff, der alles dafür tut und sogar eine ziemlich große Kraft besitzt um leicht Elektronen an sich zu binden. Stickstoff gibt widerwillig seine Elektronen ab, was dem Sauerstoff in eine ungünstige, energetische Situation verfrachtet. Zumal das Sauerstoff zwei freie Elektronenpaare hat, ist es ihm ein sehr leichtes Unternehmen einfach Wasserstoff zu sich rüber zu ziehen und die Elektronenverteilung richtet sich neu aus.
Dadurch kommt deine instabile Form in eine in Relation sehr stabile Form.
Stickstoff teilt nun drei Elektronen und Sauerstoff hat das Wasserstoff an sich gebunden. Ideal.

Beachte mal die Antwort von FK1954, er kann da deutlich mehr zu sagen. :)

Nicht mit zwei Doppelbindungen. Man kann aber durchaus ein Molekül mit dieser Atomanordnung formulieren. Dann muss ein O-Atom einfach gebunden sein und eine negative Ladung tragen, der Stickstoff ist dafür positiv geladen.
Dass das so geht, sieht man an der Strukturformel für Salpetersäure.
Die Verbindung heißt Iso-salpetrige Säure.
Wenn man auf englisch sucht (iso-nitrous acid) findet man sogar etwas dazu.
Ist energetisch ungünstiger als die "richtige" Form.


Nicht wirklich. Selbst die salpetrige Säure kann man ja nicht in Substanz isolieren.
Stabil sind allerdings die Organo-Derivate der isosalpetrigen Säure. Das sind nämlich die — Überraschung — Nitroverbindungen (H durch R ersetzen).

Nicht mit zwei Doppelbindungen.
Hast du auch eine Erklärung, warum es so ist?
Dein Link hilft leider nur wenig weiter. Eine Zeichnung wäre einfacher, aber ich glaube ich weiß trotzdem was du meinst.

Stickstoff kann nur 4 Elektronenpaarbindungen ausbilden (siehe Oktettregel).

Ich glaube das liegt u.a. an der Delokalisierung der Elektronen.
Wenn zwei Sauerstoffatome mit einem Zentralatom verbunden sind, dann kann man nicht genau sagen, wo sich die Elektronen der Bindungen zwischen Zentralatom und Sauerstoffatomen befinden. Sie liegen irgendwo in der Mitte und teilen sich irgendwie eine Bindung zum Zentralatom, sozusagen. Dadurch sind in Summe nicht zwei Doppelbindung nötig, sondern nur zwei Einfachbindungen samt einer zusätzlichen Bindung die delokalisiert ist, jedenfalls die Elektronen.
Das ist Stoff der 11/12/13 Klasse in Chemie, Thematik: Mesomere Grenzformeln.

Genau. Die Mesomerie ist mir klar.
Ich wusste nur nicht, warum nicht einfach zwei Doppelbindungen vorliegen.
Aber FK1954 hat mich ja schon auf die Oktettregel hingewiesen. Das war mein Fehler.


Eine Frage hätte ich dazu noch: Woran liegt diese Delokalisierung eigentlich?
Ich meine, ich habe mir gemerkt, dass das so beim Sauerstoff der Fall ist. Aber woran liegt dies? Liegt das an der Biradikalität des Sauerstoffs, wodurch die einzelnenden Elektronen sich zwanghaft ein anderes suchen um als freie Elektronenpaar durchzugehen, diese aber nicht finden, da diese nicht konform mit der biradikalen Struktur des Sauerstoffs ist?

Eine Frage hab ich doch noch (ich hoffe das wird jetzt nicht zu unübersichtlich hier.)
Ein anderes Beispiel war PO4. Das ist in der Lösung mit 3 Einfach- und 1 Doppelbindung gezeichnet (P natürlich in der Mitte mit 4 O außenrum). Hier wird die Oktettregel deshalb nicht verletzt, weil auch dort Mesomerie vorliegt, oder? Obwohl das anders gezeichnet ist hat das P eigentlich trotzdem nur 4 Einfachbindungen. Oder hab ich da jetzt wieder was falsch verstanden?

Ich will jetzt nicht deine Welt zerstören und bitte vergesse nicht den Hinweis des Oktettregels, aber hier schlägt dann wieder ein Fehler bei mir ein:
Es gibt doch auch hypervalente Strukturen, die eben nicht der Oktettregel entsprechen und diese auch sprengen, wenn z.B. mehr Bindungen eingegangen werden als die Oktettregel entspricht und dies ist doch der Fall oder (an FK1954 gerichtet).

Bei hypervalenten Molekülen werden/wurden verschiedene Erklärungen herangezogen.
Verwendung von d-Orbitalen (vor ein paar Jahrzehnten allgemein akzeptiert, jetzt überhaupt nicht mehr).
Mehrzentren-Bindungen (kommen häufig vor, einleuchtend)
Verwendung von antibindenden MOs (die in diesen Fällen immerhin günstiger sind als gar keine Bindung - schwierig)
Man sollte sich immer vor Augen halten, dass Elektronen immer versuchen, Positionen mit positiver Ladungsdichte aufzusuchen und so eine Bindung zu erzeugen (auch Elektronenpaarbindungen sind elektrostatischer Natur!).
Wir haben nachher das Problem, das irgendwie darzustellen oder gar zu erklären...

In der Aufgabenstellung stand ausdrücklich, "unter Berücksichtigung der Oktettregel". Das hab ich nur vergessen zu erwähnen.
Für eine so kleine Grundlagenvorlesung sollte das reichen. Von hypervalenten Bindungen war dort nicht die Rede.




Was sagt mir das?
Die Seite hab ich natürlich auch schon gefunden...
Ok, das erscheint mir logisch. Danke.